Tumore
Enciclopedia Italiana - VI Appendice (2000)
Tumore
(XXXIV, p. 474; App. II, ii, p. 1030; III, ii, p. 990; IV, iii, p. 693; V, v, p. 592)
Basi molecolari dell'oncologia: oncogeni e antioncogeni
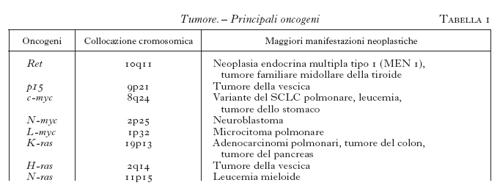
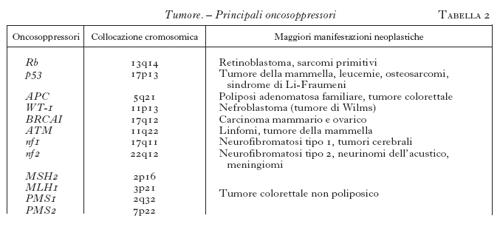
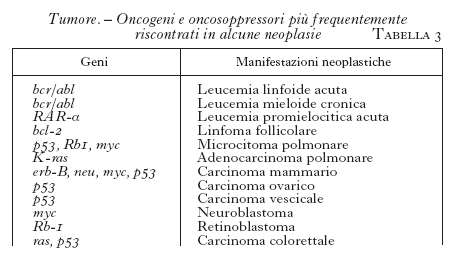
In questi ultimi anni, notevoli progressi sono stati compiuti nell'ambito dell'oncologia sperimentale e dell'oncologia clinica. Non essendo possibile esporre in poche pagine i molteplici aspetti di questo sviluppo, vengono esaminati nella presente voce i dati di più immediato interesse nell'ambito della patogenesi, della diagnostica, della prognosi e della terapia delle neoplasie umane. Una delle più grandi, recenti scoperte nell'ambito dell'oncologia, prima sperimentale, poi clinica, è stata la caratterizzazione delle alterazioni geniche che si riscontrano in pratica in ogni forma tumorale. In altri termini, il nostro patrimonio genetico, fin dalla nascita, o durante la vita per varie cause, contiene strutture che possono, in maniera determinante, favorire od ostacolare lo sviluppo delle cellule neoplastiche. I geni che intervengono in questi meccanismi patogenetici sono stati definiti rispettivamente oncogeni e antioncogeni (od oncosoppressori). Gli oncogeni sono geni che codificano proteine la cui funzione non normale è causa della trasformazione di una cellula normale in una cellula tumorale; la grande maggioranza di tali oncogeni agisce come fattore direttamente stimolante la proliferazione cellulare. Gli antioncogeni od oncosoppressori, invece, si oppongono all'azione degli oncogeni, impedendo la loro espressione e quindi la stimolazione alla proliferazione cellulare; quando gli oncosoppressori sono assenti (per delezione o inattivazione), gli oncogeni possono esprimere al massimo la loro attività. Da tale descrizione risulta che lo sviluppo delle cellule neoplastiche può dipendere anche da uno squilibrio di strutture presenti nel nostro genoma. In realtà gli oncogeni esistono nell'uomo normale come protoncogeni inattivi che, per provocare un tumore, debbono essere attivati, attraverso una mutazione che viene indotta da uno dei molti agenti cancerogeni conosciuti (cancerogeni chimici, virus, radiazioni). Negli ultimi anni è progressivamente cresciuto il numero di oncogeni identificati (tab. 1), di oncosoppressori (tab. 2) e di proteine da loro codificate, le cui funzioni sono in parte correlate con il controllo del ciclo cellulare e in parte sconosciute. In base ai numerosi studi clinici condotti in tale campo dell'oncologia, in rapido sviluppo, è possibile mettere in correlazione alcune neoplasie con diversi oncogeni e oncosoppressori (tab. 3). Comunque, a parte i non frequenti casi di t. trasmessi ereditariamente (meno del 5%), la grande maggioranza dei cancri 'sporadici' rappresenta un esempio di malattia nella cui patogenesi intervengono differenti fattori geneticamente determinati (v. anche oncogeni, App. V e in questa Appendice).
Fattori oncogenici ambientali
Abbiamo finora esaminato le possibili modificazioni del nostro patrimonio genetico che possono favorire in modo più o meno marcato lo sviluppo dei tumori. Tuttavia anche fattori esterni all'individuo, presenti cioè nell'ambiente in cui egli vive, possono indurre modificazioni a livello cellulare tali da provocare lo sviluppo del cancro. In questo vasto gruppo di cause cosiddette ambientali possiamo distinguere i seguenti, principali fattori:
1) fattori geofisici: tra questi, sicuramente le radiazioni sono i più importanti; in particolare negli ultimi anni è stata sottolineata l'importanza della prolungata esposizione ai raggi ultravioletti, che può essere responsabile dell'insorgenza di t. della pelle (melanoma, epiteliomi), specialmente nei soggetti di carnagione chiara;
2) inquinamento ambientale vero e proprio: l'inquinamento determinato dai prodotti industriali (in particolare idrocarburi aromatici policiclici, vari prodotti di scarico, prodotti derivati dalla combustione del tabacco, arsenico, asbesto) svolge sicuramente un ruolo importante in diverse forme di t., tanto è vero che l'incidenza di alcune neoplasie aumenta in quei soggetti che per cause lavorative o per abitudini alimentari o per abitudini voluttuarie sono maggiormente esposti al contatto con determinate sostanze;
3) fattori oncogenici ambientali del tutto particolari sono i virus. Numerosi studi sono stati dedicati alla capacità di alcuni virus di indurre o comunque di favorire lo sviluppo di neoplasie umane. Le nostre attuali conoscenze riguardano principalmente il ruolo svolto dal virus di Epstein-Barr (causa della mononucleosi infettiva), dai papillomavirus umani, dal virus B dell'epatite, dalla famiglia degli HTLV, cui appartiene il virus responsabile della sindrome da immunodeficienza acquisita (HIV). Ciascuno di questi virus interviene nella patogenesi di specifiche neoplasie, con meccanismi in parte non ben conosciuti. In ogni caso, la sola infezione da parte di uno di questi virus non provoca il cancro, per il cui sviluppo è necessaria la contemporanea presenza di modificazioni del DNA, spontanee o indotte da altri cofattori;
4) un particolare gruppo di fattori oncogenici ambientali è costituito dai farmaci; tra questi risultano dotati di attività oncogenica i farmaci chemioterapici impiegati nel trattamento delle leucemie, dei linfomi e dei t. solidi, e i farmaci immunosoppressori impiegati nel trattamento delle malattie autoimmuni. Per tutti gli altri medicamenti, il rischio di provocare neoplasie è notevolmente più basso, anche per gli estrogeni che, somministrati per lunghi, ininterrotti periodi, sono stati correlati con lo sviluppo del carcinoma dell'endometrio e del carcinoma della mammella;
5) come abbiamo già accennato, gli alimenti possono svolgere un ruolo nello sviluppo delle neoplasie. In particolare, anche in base a numerose indagini epidemiologiche, si ritiene che l'alimentazione possa intervenire nell'oncogenesi attraverso diversi meccanismi, come la presenza di cancerogeni o di procancerogeni, l'influenza sulla biosintesi di cancerogeni endogeni, ovvero sul trasporto, attivazione o inattivazione di cancerogeni, la possibile azione cocancerogena, e infine il sovraccarico alimentare abituale. È anche vero che negli alimenti sono presenti fattori protettivi che svolgono un ruolo antineoplastico, come vitamina B6, vitamina E, vitamina C, vitamina A, e i fattori antiossidanti in genere (v. nutrizione, in questa Appendice);
6) infine, tra i fattori ambientali di natura voluttuaria, il fumo ha una chiara e ampiamente dimostrata attività oncogenica. Nel fumo infatti sono presenti almeno due categorie di sostanze ad attività cancerogena, cioè gli idrocarburi aromatici policiclici e le nitrosamine. Questi composti svolgono probabilmente un'azione sinergica, inducendo anche fenomeni flogistici cronici polmonari che, a loro volta, possono favorire lo sviluppo del t. del polmone. Tra le cause oncogeniche di natura voluttuaria va anche ricordato l'alcool, il cui ruolo, specialmente a carico del fegato, è tuttavia sicuramente meno importante e meno direttamente coinvolto nello sviluppo delle neoplasie.
Progressi nella diagnostica oncologica
La diagnosi oncologica definitiva rimane quella istopatologica. L'impiego di ulteriori mezzi diagnostici, come l'utilizzo di anticorpi monoclonali in immunoistochimica o in citometria a flusso, pur migliorando e approfondendo le nostre capacità diagnostiche a livello tessutale, nulla hanno tolto all'importanza insostituibile di un esame istopatologico eseguito su biopsia o su frammento operatorio.
Negli ultimi anni invece sono stati compiuti notevoli progressi nella cosiddetta diagnostica per immagini, cioè in tutte quelle tecniche che permettono di 'vedere' la neoplasia, anche nelle sedi più difficilmente raggiungibili con metodiche standard. I risultati ottenuti in questo campo della diagnostica possono essere più facilmente chiariti esponendo i dati relativi ai t. più frequenti. Per la diagnosi di carcinoma della mammella, la mammografia rimane l'esame standard di routine per l'identificazione di questa neoplasia, anche se di volume inferiore a 1 cm. La mammografia possiede una specificità relativamente bassa, con la possibilità di fornire risultati falsamente positivi, specialmente in giovani donne con mammelle dense. Per tali motivi si sono utilizzate nuove metodiche che possono compensare la bassa specificità della mammografia. Per es., la FDG-PET (FluoroDeoxyGlucose Positron Emission Tomography) e la scintigrafia eseguita iniettando un anticorpo monoclonale diretto contro il CEA (CarcinoEmbryonic Antigen, un marcatore tumorale presente spesso nel siero delle pazienti con t. del seno) posseggono un'alta specificità, anche se la loro capacità di documentare lesioni tumorali minori di 1 cm è inferiore a quella della mammografia.
Nell'ambito del carcinoma del colon, un problema diagnostico di grande importanza è costituito dalla dimostrazione della presenza di eventuali metastasi epatiche. A tale scopo oggi si utilizzano l'ecografia e più specificatamente la tomografia computerizzata (TC); tuttavia con tali indagini è possibile ottenere sia false positività sia false negatività. L'impiego dell'immunoscintigrafia, utilizzando un anticorpo monoclonale diretto contro il CEA (prodotto anche, con altissima frequenza, dai carcinomi del colon), permette una migliore identificazione della presenza della malattia sia nel fegato sia in sedi extraepatiche, con una riduzione del 40% dei risultati falsamente negativi.
Infine anche nel tumore del polmone non microcitoma (NSCLC, Non Small Cell Lung Carcinoma) - che costituisce circa l'80% di tutte le neoplasie polmonari - la tomografia computerizzata del torace e dell'addome fornisce importanti informazioni sull'estensione della neoplasia e quindi sulla sua eventuale resecabilità chirurgica. Tuttavia la sensibilità della tomografia computerizzata, come del resto della risonanza magnetica nucleare (RMN), è relativamente bassa, intorno al 50%. Così, anche in questa neoplasia si stanno valutando le sensibilità di metodiche più moderne, come la FDG-PET, la 201Tl SPET (Single Photon Emission Tomography, che impiega 99Tcm-tetrafosmina), e l'immunoscintigrafia, utilizzando anticorpi monoclonali diretti contro costituenti della cellula polmonare neoplastica (come l'NR-LU-10).
Caratterizzazione prognostica delle neoplasie
Uno dei problemi più attuali dell'oncologia clinica è rappresentato dall'identificazione dei fattori intrinseci alle neoplasie che ne determinano la prognosi. Si tratta di un ampio campo di studio, in continuo sviluppo. In realtà i fattori prognostici che vengono analizzati possono essere suddivisi in tre grandi gruppi: 1) fattori clinico-patologici; 2) fattori correlati alla cinetica cellulare; 3) fattori più direttamente correlati con il patrimonio genetico della cellula neoplastica.
1) Fattori clinico-patologici: costituiscono i fattori da più tempo identificati e studiati, e che, con il passar degli anni, non hanno assolutamente perduto la loro importanza. Così costituiscono fattori prognostici negativi la giovane età del paziente, la maggior grandezza del t., la più marcata atipia delle cellule neoplastiche (cioè la minore somiglianza con le cellule normali dello stesso tessuto), le caratteristiche morfologiche del nucleo, il precoce interessamento dei linfonodi adiacenti la neoplasia. Altri aspetti istopatologici rivestono un ruolo prognostico negativo, come la presenza di necrosi diffusa, l'infiltrazione dei tessuti peritumorali, la reazione linfocitaria peritumorale e, nel carcinoma della mammella, la negatività della presenza dei recettori per gli estrogeni o per il progesterone. Più di recente, particolare importanza prognostica viene data ai fenomeni di neoangiogenesi (cioè formazione di nuovi vasi sanguigni nell'ambito dei t.) e ai fattori che la regolano, come il VEGF (Vascular Endothelial Growth Factor) e gli attivatori e inibitori della fibrinolisi, nonché all'espressione delle metalloproteinasi della matrice connettivale. Il ruolo prognostico di altri parametri in specifiche neoplasie (per es. la catepsina D nel carcinoma della mammella) non è ancora ben definito.
2) Fattori correlati alla cinetica cellulare: l'analisi del ciclo cellulare, effettuata con varie metodiche, viene eseguita da vari anni in studi che hanno chiaramente dimostrato il ruolo prognostico dei parametri direttamente correlati al contenuto di DNA e alle varie fasi del ciclo cellulare: così è stato dimostrato che molte neoplasie (fino al 40%) hanno un contenuto anormale di DNA (cioè sono aneuploidi, anziché diploidi come le cellule normali). L'aneuploidia costituisce, già da sola, un fattore prognostico negativo. Nello stesso tempo l'analisi della percentuale delle cellule neoplastiche in fase S (cioè che si stanno duplicando), valutata con varie metodiche, come l'incorporazione della timidina marcata (TLI, Thymidine Labelling Index), la determinazione citofluorimetrica, l'indice di marcatura eseguito utilizzando l'anticorpo anti-Ki 67, può costituire, in alcune neoplasie, un fattore prognostico negativo quando tale percentuale risulti elevata.
3) Fattori correlati con il patrimonio genetico della cellula neoplastica: spesso direttamente correlate con le alterazioni della cinetica cellulare sono le modificazioni, congenite o acquisite, del patrimonio genetico della cellula neoplastica, in particolare per quanto riguarda l'attivazione degli oncogeni e l'inattivazione dei geni oncosoppressori. Si tratta di uno degli argomenti più largamente analizzati nella letteratura mondiale, anche per quanto riguarda il ruolo prognostico che tali modificazioni hanno nelle singole neoplasie. È praticamente impossibile sintetizzare l'enorme mole di studi a tal riguardo; va soltanto sottolineato che molte osservazioni sono state dedicate al contenuto intracellulare di vari oncogeni attivati od oncosoppressori, come erb-B, MDM2, p53, K-ras, bcl-2, bax.
Moderni aspetti della terapia dei tumori
Il ruolo del 'linfonodo ascellare' nel trattamento chirurgico del carcinoma della mammella
Uno degli aspetti ancora da approfondire, nell'ambito del trattamento chirurgico dei t., riguarda la necessità di effettuare o meno, e in quali casi, il cosiddetto svuotamento ascellare dei linfonodi delle pazienti con carcinoma della mammella. Classicamente, l'asportazione dei linfonodi ascellari omolaterali al t. del seno costituisce una tappa essenziale per definire l'ulteriore trattamento medico. A questa possibilità, che può avere le sue complicanze, come l'ostacolato deflusso linfatico nell'arto superiore, esistono alcune alternative, come l'impiego di una radioterapia ascellare (che studi clinici controllati hanno dimostrato essere efficace quanto l'asportazione dei linfonodi ascellari) o come, più di recente, l'identificazione del cosiddetto linfonodo 'sentinella', cioè del primo linfonodo che drena le cellule tumorali, il cui aspetto dovrebbe corrispondere a quello dell'intero gruppo di linfonodi ascellari. In uno studio dell'Istituto europeo di oncologia di Milano, in 250 donne con carcinoma operabile della mammella è stata eseguita la linfoscintigrafia (con particelle colloidali marcate con 99mTc), associata a una probe (sonda) rilevabile con raggi gamma e, in alcuni casi, alla somministrazione di un colorante blu. Quindi in tutte le donne è stato effettuato uno svuotamento completo dei linfonodi ascellari. I dati più importanti di questo studio riguardano l'identificazione del linfonodo sentinella nel 96% delle pazienti, e l'osservazione che la biopsia di tale linfonodo predice correttamente lo stato dei linfonodi ascellari nel 97,5% dei casi. Questa e altre recenti osservazioni inducono a ritenere che in un prossimo futuro il trattamento chirurgico dei linfonodi ascellari nel carcinoma della mammella potrà essere limitato ad alcune pazienti, cioè quando è veramente necessario, secondo le indicazioni fornite dall'analisi del linfonodo sentinella, come, per via della maggiore esperienza che se ne ha, già avviene nel melanoma.
La chemioterapia ad alte dosi
Fino ad alcuni anni fa la chemioterapia per il trattamento dei t., sia in fase non metastatica sia in fase metastatica, era basata sull'utilizzazione di protocolli terapeutici in cui vari farmaci venivano somministrati in determinate dosi e a precise scadenze, fondamentalmente tenendo presente il rapporto dose-tossicità, per non esporre il paziente a complicanze gravi, anche mortali. Successivamente, in base a studi sperimentali e ad analisi retrospettive sugli effetti dose-risposta della chemioterapia, è stato dimostrato che la risposta terapeutica alla chemioterapia dipende essenzialmente dall'intensità di dose (DI, Dose-Intensity), cioè dalla quantità di farmaco somministrato nell'unità di tempo (mg/m²/settimana). Ben presto risultò evidente che un'efficace chemioterapia può essere effettuata soltanto aumentando l'intensità di dose, e questo, a sua volta, comporta un aumento marcato della tossicità ematologica dei farmaci antitumorali. Così, se da una parte è chiaro con quali modalità può essere più attiva la chemioterapia, dall'altra parte, per evitare gravi insufficienze del midollo osseo, è necessario prevenire questa grave complicanza della chemioterapia ad alte dosi. Per raggiungere tale scopo, l'oncologo oggi può utilizzare, anche congiuntamente, due sistemi: 1) l'impiego dei cosiddetti fattori di crescita midollare; 2) il trapianto del midollo osseo, o, più recentemente, di cellule staminali da sangue periferico.
I fattori di crescita sono proteine fisiologicamente prodotte nell'uomo sano da cellule del midollo osseo, da cellule del sistema linfoide e da altre cellule allo scopo di permettere alla cellula staminale totipotente, altamente indifferenziata, di andare incontro a processi di differenziazione e di maturazione, alla fine dei quali verranno prodotte le cellule del normale sangue periferico. Alcuni fattori di crescita sono altamente specifici per singole linee cellulari, come l'eritropoietina per la serie eritroblastica (da cui derivano i globuli rossi), la trombocitopoietina per la serie megacariocitaria (da cui derivano le piastrine), il GM-CSF e il G-CSF (Granulocyte[Macrophage]-Colony Stimulating Factor) per le serie granuloblastica e monocitaria. Anche alcune citochine prodotte dai linfociti (come le interleuchine 1, 2, 3, 6, 7) agiscono in maniera sinergica con i fattori di crescita veri e propri. L'impiego di questi fattori di crescita nei pazienti neoplastici che, in seguito a chemio- o radioterapia, presentino una grave riduzione dei globuli rossi, dei granulociti, delle piastrine nel sangue periferico, permette, a dosi adeguate, una pronta risposta da parte del midollo osseo e la normalizzazione del sangue periferico. In realtà numerosi studi clinici sono stati dedicati all'impiego della chemioterapia ad alte dosi con il solo supporto dei fattori di crescita, per es. nei t. della mammella, dell'ovaio, del polmone, del testicolo.
Contemporaneamente si sono sviluppate, in modo quasi tumultuoso, le procedure per effettuare, anche nei pazienti con t. solidi, il trapianto di midollo osseo autologo attraverso l'impiego di cellule staminali prelevate, mediante separatore cellulare, dal sangue periferico. Tutto ciò è oggi possibile grazie alla scoperta che le cellule staminali (da cui derivano tutte le cellule del midollo osseo e del sangue) sono presenti nel sangue periferico e che la loro concentrazione, fisiologicamente bassa, può essere incrementata con la somministrazione di alcuni farmaci, come chemioterapici e fattori di crescita. Così il paziente neoplastico può essere sottoposto a una chemioterapia ad alte dosi, corrispondenti a un'efficace Dose-Intensity; quando, in seguito a tale terapia, il midollo osseo sarà divenuto aplastico, il paziente riceverà le cellule staminali prelevate da lui stesso prima dell'inizio della chemioterapia e conservate a -180 °C. Le cellule, infuse per via venosa, andranno a colonizzarsi nel midollo osseo, dove dopo l'attecchimento prolifereranno e si differenzieranno nelle varie serie cellulari midollari e quindi ematiche. Su questo schema estremamente semplificato sono state attuate diverse varianti come, per es., l'impiego di cellule staminali da donatore sano, l'utilizzazione contemporanea di un chemioterapico e di un fattore di crescita, il trattamento della sospensione di cellule staminali per eliminare una possibile contaminazione da parte di cellule neoplastiche. Tutto ciò fa comprendere come l'impiego di cellule staminali dal sangue periferico e dei fattori di crescita costituisca un grande progresso nel trattamento medico delle neoplasie, anche se numerosi aspetti debbono ancora essere chiariti prima che questa metodologia possa essere definitivamente standardizzata (v. sangue, in questa Appendice).
La immunoterapia delle neoplasie umane
Diverse osservazioni, inizialmente di tipo sperimentale, hanno documentato l'esistenza di rapporti tra sistema immunitario e sviluppo di neoplasie umane. La proliferazione delle cellule tumorali può essere, almeno in parte, dovuta ad alterazioni del sistema immunitario che, in condizioni fisiologiche, impedisce lo sviluppo delle cellule anomale. Negli ultimi anni sono stati riportati difetti delle varie componenti cellulari della risposta immune, il possibile ruolo negativo svolto da fattori umorali o da fattori derivati dalle neoplasie. Molto resta ancora da chiarire sulla natura delle cellule immunitarie effettrici, sulle interazioni tra cellule neoplastiche e cellule del sistema immunitario, sull'identificazione delle strutture cellulari specifiche delle cellule neoplastiche che vengono riconosciute dal sistema immunitario. In generale si può affermare che una stimolazione del sistema immunitario nel paziente neoplastico può provocare una risposta in grado di contrastare lo sviluppo del tumore. Su questa possibilità si sono sviluppate due principali linee di trattamento tendenti a potenziare la risposta immunitaria: da una parte sono state impiegate citochine (cioè sostanze capaci di indurre un ampio spettro di risposte immunitarie, compresa un'attività antiproliferativa nei confronti di alcune cellule tumorali), come l'interleuchina 2, gli interferoni, il fattore di necrosi tessutale; dall'altra parte sono stati indotti alla proliferazione i linfociti dello stesso paziente neoplastico, che infiltrano il t. e che quindi sono espressione di una reazione immunitaria ritenuta specifica nei confronti delle cellule neoplastiche stesse.
Per quanto riguarda l'utilizzazione delle citochine nelle neoplasie umane, dopo una fase di ampia sperimentazione clinica in vari tipi di t. solidi, attualmente si può affermare che, associate o meno alla chemioterapia, alcune citochine presentano un certo grado di efficacia in specifici t. umani: l'interleuchina 2, somministrata per via endovenosa o per via sottocutanea, è attiva nelle forme metastatiche di melanoma, di carcinoma renale, di carcinoma colorettale, anche dopo metastasectomia, nel carcinoma ovarico resistente al cisplatino; l'interferone-α è attivo nel melanoma, nel sarcoma di Kaposi associato all'AIDS, nell'osteosarcoma, nel trattamento locale del carcinoma della vescica, oltre che in alcune forme neoplastiche di ordine ematologico, come il mieloma multiplo.
Per quanto riguarda i TIL (Tumor-Infiltrating Lymphocytes), una volta isolati dalla neoplasia, possono essere espansi in vitro in presenza di interleuchina 2, e quindi reinfusi al paziente. Diversi studi clinici controllati sono stati eseguiti in pazienti con vari tipi di neoplasie, per es. di origine ginecologica. I risultati più promettenti sono stati comunque ottenuti nei soggetti affetti da melanoma, con una risposta terapeutica nel 30% circa dei casi. I TIL sono generalmente linfociti T, contenenti prevalentemente la sottopopolazione CD8-positiva. Essi riconoscono le cellule tumorali autologhe, cioè della neoplasia da cui sono stati isolati, e verso le quali svolgono un effetto citotossico. Il ruolo definitivo dell'impiego dei TIL nel trattamento dei pazienti neoplastici (specialmente con melanoma) dipende essenzialmente dai continui progressi nella preparazione dei TIL dalle neoplasie, nella loro espansione in vitro e nella loro adeguata infusione nei pazienti.
La radioimmunoterapia dei tumori solidi
La radioimmunoterapia è una forma relativamente nuova, e tutta da sviluppare, di trattamento delle neoplasie, basata sull'impiego di anticorpi diretti contro strutture relativamente specifiche delle cellule tumorali e coniugati con un radionuclide: in tal maniera il tracciante radioattivo andrà a localizzarsi nelle strutture neoplastiche provocando il massimo effetto radioterapico a livello locale. Tale forma di terapia presenta pertanto una serie di possibili vantaggi rispetto ad altre forme convenzionali di trattamento antineoplastico, in quanto si tratterebbe di una forma senza importanti effetti collaterali e mirata al tessuto tumorale. Esistono tuttavia ancora delle problematiche da risolvere: per es., è possibile che l'anticorpo non penetri sufficientemente nella cellula tumorale; è possibile che il tracciante radioattivo attraversi anche il tessuto midollare osseo, provocando fenomeni di mielotossicità; infine gli anticorpi che si utilizzano in questa forma di trattamento sono di origine murina o di altro animale, e possono così provocare, dopo ripetute somministrazioni, fenomeni di resistenza immunologica, con possibile necessità di aumentare la dose da iniettare. I progressi in tale campo della terapia dei t. sono in continuo sviluppo; per es., alla fine degli anni Novanta è stato applicato un protocollo di radioimmunoterapia che prevede un trattamento in tre fasi, consistenti nell'iniezione di anticorpi monoclonali biotinilati, nella successiva somministrazione combinata di avidina e streptavidina, e infine nella somministrazione di biotina radiomarcata con Indio-111. È possibile così somministrare elevate dosi di radiotracciante, risparmiando il midollo osseo e altri organi.
bibliografia
G. Bonadonna, G. Robustelli della Cuna, Manuale di oncologia medica, Milano 1981, 1999⁵.
G.M. Pontieri, Patologia generale, 2 voll., Padova 1987-90, 1996-97².
U. Veronesi et al., Manuale di senologia oncologica, Milano 1995.
G.M. Gandolfo et al., Fibrinolysis components as prognostic markers in breast cancer and colorectal carcinoma, in Anticancer research, 1996, pp. 2155-59.
J.R. Yannelli et al., Growth of tumor-infiltrating lymphocytes from human solid cancers: summary of a 5-years experience, in International journal of cancer, 1996, pp. 413-21.
C. Boshoff et al., Etiology of AIDS-related Kaposi's sarcoma and lymphoma, in Oral diseases, 1997, Suppl. 1, pp. 129-32.
C. Garufi et al., A phase I trial of 5-day chronomodulated infusion of 5-fluorouracil and 1-folinic acid in patients with metastatic colorectal cancer, in European journal of cancer, 1997, pp. 1566-71.
D.M. Goldenberg, Perspectives on oncologic imaging with radiolabeled antibodies, in Cancer, 1997, pp. 2431-35.
M. Hahka-Kemppinen et al., DNA flow cytometry and the outcome of chemoimmunotherapy in metastatic melanoma, in Melanoma research, 1997, pp. 329-34.
A. Hakansson et al., Effect of interferon-alpha on the expression of tumour necrosis factor-alpha by metastatic malignant melanoma in vivo, in Melanoma research, 1997, pp. 139-45.
T. Schondorf et al., Cellular characteristics of peripheral blood lymphocytes and tumour-infiltrating lymphocytes in patients with gynaecological tumours, in Cancer immunology immunotherapy, 1997, pp. 88-96.
S. Vadhan-Raj et al., Stimulation of megakaryocyte and platelet production by a single dose of recombinant human thrombopoietin in patients with cancer, in Annals of internal medicine, 1997, pp. 673-81.
S. Vella et al., Herpesvirus saimiri-immortalized human T-cells support long-term, high titred replication of human immunodeficiency virus types 1 and 2, in Journal of general virology, 1997, pp. 1405-09.
A.S. Arbab, K. Koizum, K. Toyama et al., Detection of lung and chest tumours using 99Tcm-tetrofosmin: comparison with 201Tl, in Nuclear medicine communications, 1998, pp. 657-63.
C.Y. Chen et al., Correlation of genetic instability and apoptosis in the presence of oncogenic Ki-Ras, in Cell death and differentiation, 1998, pp. 984-95.
P. Collecchi et al., Primary chemotherapy in locally advanced breast cancer (LABC): effects on tumour proliferative activity, bcl-2 expression and the relationship between tumour regression and biological markers, in European journal of cancer, 1998, pp. 1701-04.
C. De Cicco et al., Lymphoscintigraphy and radioguided biopsy of the sentinel axillary node in breast cancer, in Journal of nuclear medicine, 1998, pp. 2080-84.
A. Eisen, B.L. Weber, Recent advances in breast cancer biology, in Current opinion in oncology, 1998, pp. 486-91.
S.H. Kuo et al., Tumour-infiltrating lymphocytes in non-small cell lung cancer are activated T lymphocytes, in Respirology, 1998, pp. 55-59.
W. Muller et al., Prognostic value of bcl-2 expression in gastric cancer, in Anticancer research, 1998, pp. 4699-704.
M.R. Nowrousian, Recombinant human erythropoietin in the treatment of cancer-related or chemotherapy-induced anaemia in patients with solid tumours, in Medical oncology, 1998, Suppl. 1, pp. 19-28.
T.F. Orntoft, H. Wolf, Molecular alterations in bladder cancer, in Urological research, 1998, pp. 223-33.
R. Ridolfi et al., Adjuvant adoptive immunotherapy with tumour-infiltrating lymphocytes and modulated doses of interleukin-2 in 22 patients with melanoma colorectal and renal cancer, after radical metastasectomy, and in 12 advanced patients, in Cancer immunology immunotherapy, 1998, pp. 185-93.
A. Russo et al., Prognostic significance of proliferative activity, DNA-ploidy, p53 and Ki-ras point mutations in colorectal liver metastases, in Cell proliferation, 1998, pp. 139-53.
A. Semczuk et al., K-ras gene point mutations in human endometrial carcinomas: correlation with clinicopathological features and patients' outcome, in Journal of cancer research and clinical oncology, 1998, pp. 695-700.
C. Smith et al., AIDS-related malignancies, in Annals of medicine, 1998, pp. 323-44.
N.E. Stavropoulos et al., Local immune response after intravesical interferon gamma in superficial bladder cancer, in British journal of urology, 1998, pp. 875-79.
T. Tanimoto et al., Growth patterns in various macroscopic types of noninvasive intramucosal colorectal carcinoma with special reference to apoptosis and cell proliferation, in Diseases of the colon and rectum, 1998, pp. 1376-84.
P.C. Willsher et al., C-erbB2 expression predicts response to preoperative chemotherapy for locally advanced breast cancer, in Anticancer research, 1998, pp. 3695-98.
D. Ye et al., Bcl-2/bax expression and p53 gene status in human bladder cancer: relationship to early recurrence with intravesical chemotherapy after resection, in Journal of urology, 1998, pp. 2025-28.
V. Bongers et al., Towards quality assurance of the sentinel node procedure in malignant melanoma patients: a single institution evaluation and a European survey, in European journal of nuclear medicine, 1999, pp. 84-90.
M. Cremonesi et al., Three-step radioimmunotherapy with yttrium-90 biotin: dosimetry and pharmacokinetics in cancer patients, in European journal of nuclear medicine, 1999, pp. 110-20.
J.A. Foekens et al., Cathepsin-D in primary breast cancer: prognostic evaluation involving 2810 patients, in British journal of cancer, 1999, pp. 300-07.
G. Fontanini et al., Expression of vascular endothelial growth factor mRNA in non-small-cell lung carcinomas, in British journal of cancer, 1999, pp. 363-69.
F.B. Vermeulen et al., Prospective study of intratumoral microvessel density, p53 expression and survival in colorectal cancer, in British journal of cancer, 1999, pp. 316-22.