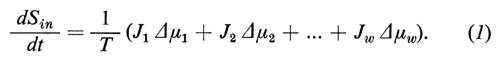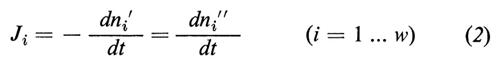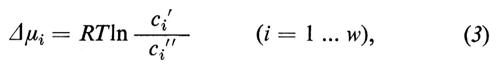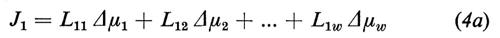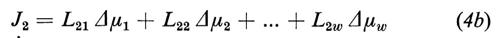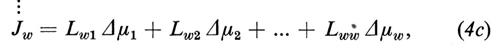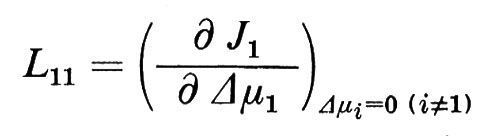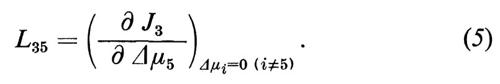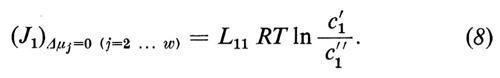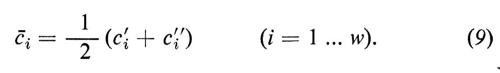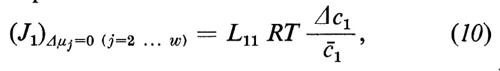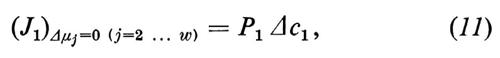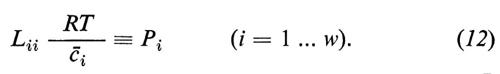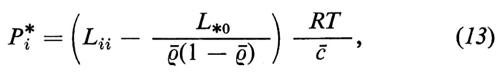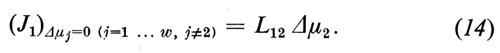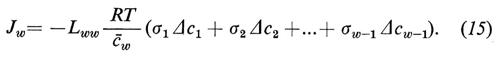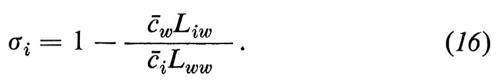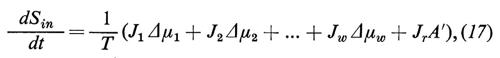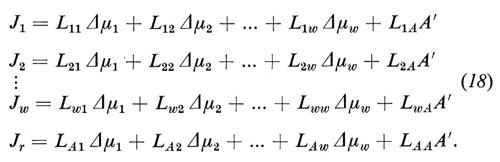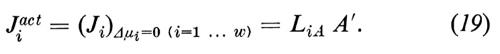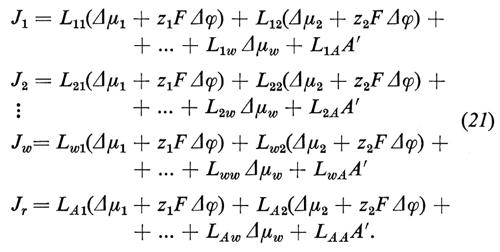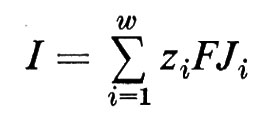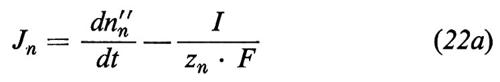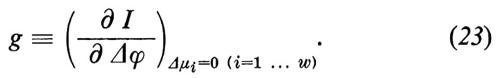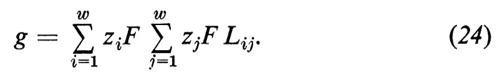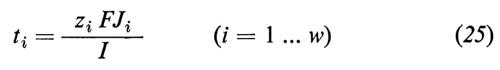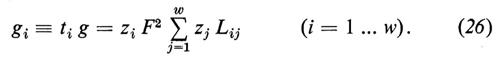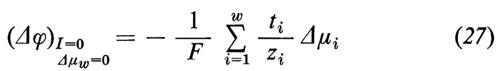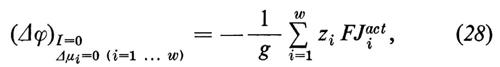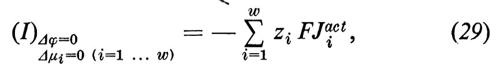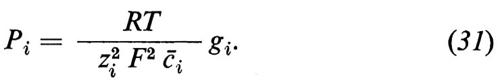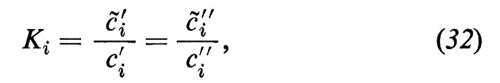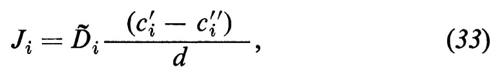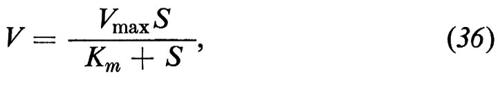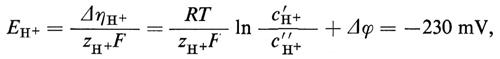Trasporto attraverso membrane biologiche
Enciclopedia del Novecento (1984)
Trasporto attraverso membrane biologiche
di Eberhard Frömter
SOMMARIO: 1. Introduzione. □ 2. Composizione e struttura della membrana cellulare. □ 3. Metodi d'analisi: a) misure di flusso; b) misure elettriche; c) altre tecniche analitiche. □ 4. Descrizione teorica dei fenomeni di trasporto (teoria fenomenologica del trasporto attraverso membrana): a) premesse, deduzioni, asserzioni generali; b) importanza dei coefficienti fenomenologici; c) trasporto attivo; d) sistemi con elettroliti. □ 5. Fenomeni di trasporto attraverso le membrane biologiche: a) trasporto per diffusione; b) trasporto tramite accoppiamento del flusso di sostanze diverse; c) trasporto attivo; d) trasporto tramite vescicole. □ Bibliografia.
1. Introduzione.
Il trasporto di sostanze attraverso le membrane è un fenomeno fondamentale per i viventi. Tutti gli esseri viventi sono separati dall'ambiente da speciali barriere costituite dalle membrane, che rendono possibile uno scambio selettivo di materiale con l'ambiente esterno e provvedono a mantenere costante nel tempo la composizione interna. Tutti i fenomeni biologici, inoltre, sono in pratica strettamente connessi ai processi di membrana. Le membrane svolgono infatti un ruolo di primaria importanza sia nella trasformazione dell'energia chimica in lavoro meccanico, osmotico o elettrico, sia nell'acquisizione e utilizzazione dell'informazione, sia, anche se in grado minore, nella riproduzione. A causa di questa molteplicità di compiti non ci si può aspettare di definire chiaramente il concetto di membrana biologica (v. biologia; cellula: Fisiologia della cellula; elettrofisiologia; neurone e impulso nervoso; sangue: Genetica del sangue; secrezione e assorbimento; ultrastrutture biologiche).
Il presente articolo tratta principalmente del trasporto di materia attraverso la membrana cellulare. Per membrana cellulare intendiamo quel doppio strato lipoproteico bilamellare che circonda senza soluzione di continuità tutte le cellule e ha la funzione di barriera principale per lo scambio di materiale tra cellula e ambiente.
Verranno inoltre discusse le caratteristiche di trasporto delle membrane subcellulari, così come quelle delle membrane pluricellulari (membrane epiteliali; v. fig. 1). Per membrane subcellulari intendiamo, qui, quei doppi strati lipoproteici che circondano i diversi organelli cellulari (mitocondri, reticolo endoplasmatico).
Le membrane epiteliali, costituite da estesi strati di cellule, si trovano negli esseri viventi di maggiori dimensioni, pluricellulari. Esse dividono il corpo dall'ambiente (pelle), oppure rivestono cavità interne (mucosa intestinale), oppure formano pareti tubulari o vescicolari (nel rene e nelle ghiandole).
Nel trattare l'argomento degli strati pluricellulari degli epiteli, vengono prese in considerazione come barriere non solo le singole pareti delle cellule epiteliali, ma anche i punti di connessione che tengono unite le cellule epiteliali adiacenti, congiungendole a formare una membrana macroscopica uniforme.
2. Composizione e struttura della membrana cellulare.
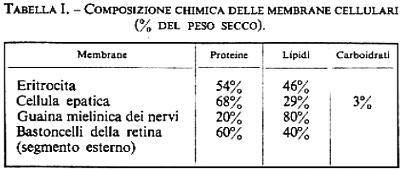
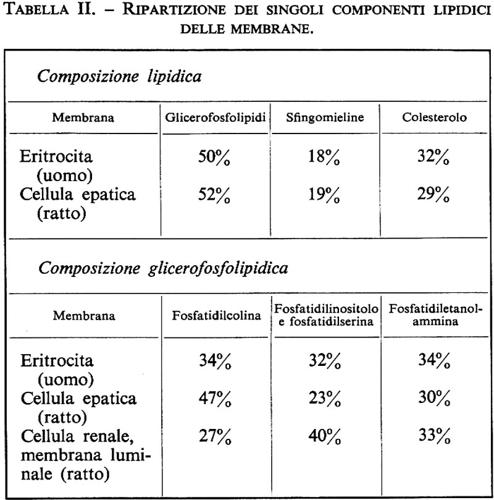
La membrana cellulare è costituita essenzialmente da lipidi e proteine. Secondo quanto indicato nella tab. I, la percentuale relativa è diversa per i differenti tipi di cellule. Esistono membrane nelle quali prevale la percentuale proteica e altre in cui predomina la quota lipidica. I lipidi sono costituiti per la maggior parte da glicerolipidi (fosfatidiletanolammina, -serina, -inositolo e -colina) così come da sfingomielina e cerebrosidi e da colesterolo (v. fig. 2). Anche nella ripartizione dei singoli componenti lipidici esistono differenze dipendenti dall'organo e dalla specie animale (v. tab. II).
Finora le proteine sono state meno caratterizzate. Mediante l'isolamento della membrana eritrocitaria e l'elettroforesi su gel di poliacrilammide e dodecilsolfato di sodio si ottengono almeno 14 bande di proteine con pesi molecolari tra 22.000 e 260.000. Finora si è riusciti solo sporadicamente a effettuare una descrizione corretta delle proteine di membrana e a correlare proteine e lipidi a specifiche funzioni della membrana.
La struttura della membrana cellulare, nonostante le differenti composizioni, appare abbastanza uniforme al microscopio elettronico. Usando tetrossido di osmio e permanganato di potassio o acetato di uranile si trova in sezione una regolare stratificazione trilaminare (v. fig. 3), costituita da due strati scuri esterni densi di elettroni, ognuno di 2,5-4 nm di spessore, nei quali si depositano i metalli pesanti (osmio), separati da uno strato più chiaro e più permeabile agli elettroni, che presenta circa lo stesso spessore (3-6 nm).
Alcune membrane, oltre a presentare relativamente poche differenze, limitate allo spessore dello strato e che possono essere specifiche di singole cellule, presentano anche tipiche appendici. Ad esempio nella parte luminale dell'orletto a spazzola dell'intestino e del rene si trovano delle strutture a bottone di circa 6 nm di diametro, che vengono scisse da un enzima proteolitico (papaina) e che contengono enzimi (nell'intestino, invertasi e maltasi; v. fig. 4). Simili strutture a forma di clava si trovano anche sulla superficie interna della membrana mitocondriale, dove hanno inizio reazioni parziali della catena respiratoria. Alcune membrane cellulari (per esempio quelle apicali intestinali) presentano un leggero strato mucopolisaccaridico sovrapposto (glicocalice).
Nelle fasi acquose i lipidi possono formare stabili strutture sopramolecolari grazie alla loro conformazione asimmetrica con un'estremità idrofila (polare) e una allungata idrofoba (apolare). All'interfaccia acqua-aria si formano film monomolecolari e nelle soluzioni acquose, trattando con ultrasuoni, si formano le cosiddette figure mieliniche o micelle, che sono masse stellari o sferiche con strati bio multilamellari, oppure si formano piccole vescicole ripiene d'acqua, i cosiddetti liposomi. Inoltre, con particolari tecniche, simili a quelle usate per ottenere le bolle di sapone, e cioè stendendo, per esempio, la soluzione lipidica su un sottile anello di teflon che viene poi inserito a mo' di membrana tra due ambienti liquidi, si possono ottenere membrane con doppio strato lipidico. È ovvio quindi ammettere che la membrana cellulare sia costituita semplicemente da molecole lipidiche allungate in un doppio strato, che viene tenuto unito soltanto dalla reciproca azione delle forze idrofile-idrofobe tra lipidi e acqua (v. fig. 5).
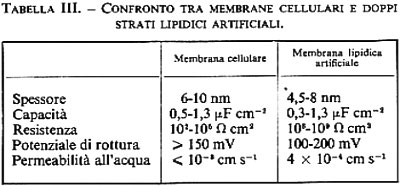
Questa rappresentazione fondamentale della struttura della membrana cellulare, che venne proposta per la prima volta da Gorter e Grendel (v., 1925), è sicuramente corretta, ma deve essere ampliata. Essa è sostenuta dalle seguenti osservazioni: 1) se da una sospensione di globuli rossi vengono estratti tutti i lipidi e vengono distesi come film monomolecolare sulla superficie dell'acqua, essi occupano un'area circa doppia rispetto a quella delle membrane originali; 2) se si analizza l'assorbimento di anelettroliti in diverse cellule, si trova una buona correlazione tra permeabilità e solubilità lipidica, il che ci induce a considerare lo strato lipidico come una barriera (v. a questo proposito la fig. 12); 3) numerose misure elettromicroscopiche, spettroscopiche ed elettriche (v. tab. III) dimostrano che struttura e proprietà dei doppi strati lipidici artificiali e delle membrane cellulari naturali concordano ampiamente; 4) se si estende una lamella del doppio strato lipidico della membrana eritrocitana (per esempio facendo immagazzinare clorpromazina, o cambiando unilateralmente il pH, il che porta a un cambiamento delle concentrazioni di cariche fisse), si può ottenere che la membrana si deformi come una fascia bimetallica.
A lungo si è discusso sulla posizione delle proteine nella membrana cellulare: secondo il modello di Danielli e Davson (v., 1935) esse avrebbero dovuto giacere ai lati dello strato lipidico. Oggi sappiamo però che una parte delle proteine, in base alla loro struttura che presenta zone superficiali idrofile e idrofobe, può formare elementi integrati nel doppio strato idrofilo-idrofobo. Esse sono collocate in una lamella lipidica, o singolarmente o in guaine più grandi; oppure giacciono tra le lamelle lipidiche o si estendono da una parte all'altra della membrana (v. fig. 6). Con la tecnica del criodecapaggio, frammenti di membrana si rompono spesso esattamente tra le lamine del doppio strato. Esponendo la superficie di rottura a vapori di Pt e C, si riconoscono in essa al microscopio elettronico numerose particelle rotonde di 6-9 nm di diametro (v. fig. 7): si tratta chiaramente di proteine che giacciono tra le due lamelle lipidiche della membrana o che si estendono attraverso l'intera membrana. Nella membrana eritrocitaria queste proteine sono responsabili della permeabilità anionica.
Nonostante sia sicuramente corretto rappresentare la membrana cellulare come un doppio strato lipidico con proteine immagazzinate, tale rappresentazione non riesce ancora a spiegarne tutte le proprietà. Avremmo potuto infatti aspettarci che tutte le cellule, similmente ai liposomi o alle bolle di sapone, possedessero forma sferica e che si sciogliessero al diretto contatto reciproco. In realtà, la maggior parte delle cellule possiede una forma tipica e sviluppa al contatto con cellule vicine strutture specifiche permanenti; è questo il caso dei desmosomi (che servono all'ancoraggio meccanico), delle sinapsi (tramite le quali vengono trasmessi segnali elettrici da una cellula all'altra), oppure dei cosiddetti nexus o gap junctions, che stabiliscono un accoppiamento elettrico diretto (per es. nelle cellule muscolari del cuore) e permettono lo scambio di piccole molecole, di peso molecolare fino a circa 1.500.
Per poter spiegare queste proprietà si deve ammettere che la cellula possieda strutture scheletriche citoplasmatiche speciali, alle quali la membrana cellulare si ancora, e che l'installazione delle proteine nella membrana cellulare avvenga non a caso, bensì in stretto rapporto con l'architettura citoplasmatica.
Possiamo considerare come strutture scheletriche sia i microtubuli sia i filamenti actinici e miosinici, che si trovano non solo nelle cellule muscolari, ma anche nelle cellule non contrattili (per es. nelle cellule epiteliali). Le cellule epiteliali dell'intestino e del rene formano sulla loro superficie apicale il cosiddetto orletto a spazzola, tramite il quale la superficie delle cellule viene enormemente estesa grazie alla presenza di numerose invaginazioni strettamente adiacenti come le dita di un guanto (microvilli; v. anche la parte superiore della fig. 13A). Questa struttura, che sarebbe assolutamente inverosimile per una membrana lipidica semplice, viene evidentemente mantenuta grazie a un reticolo di filamenti actinici e miosinici, che si estende attraverso il polo superiore delle cellule, dal quale partono singoli filamenti di actina che si inseriscono all'interno dei microvilli, per poi ancorarsi più volte (v. tessuto muscolare e ultrastrutture biologiche).
Parimenti, la forma a disco biconcavo dei globuli rossi viene mantenuta tramite un citoscheletro di filamenti actinici: questi sono ancorati a una rete di filamenti di spettrina che rivestono la superficie interna della membrana cellulare e aderiscono direttamente a un'altra proteina, cioè alla proteina di membrana, che media il trasporto anionico. L'incorporazione di proteine nella membrana è selettivamente regolata dai punti di ancoraggio.
La fig. 6 dà un'immagine statica della membrana che non corrisponde alla realtà, in quanto alla temperatura corporea i lipidi della membrana cellulare sono in fase liquida.
Misure di risonanza nucleare e misure di risonanza dello spin elettronico con l'aiuto di composti lipidici con sostituzioni N−O (spin label) indicano che le molecole lipidiche si trovano costantemente in movimento sia nei doppi strati lipidici artificiali sia nelle membrane naturali. Due molecole fosfolipidiche vicine possono cambiare il loro posto circa 10 milioni di volte al secondo. Lo scambio di fosfolipidi tra le due lamelle di un doppio strato lipidico (movimento di flip-flop) avviene invece molto lentamente (tempo medio 6 ore).
Sembra che il comportamento delle membrane cellulari sia molto simile. Poiché la fosfolipasi scinde i lipidi di membrana secondo il lato della membrana che viene esposto a trattamento, i fosfolipidi della membrana eritrocitaria dell'uomo devono essere disposti asimmetricamente (fosfatidilcolina e sfingomielina sul lato esterno, fosfatidiletanolammina sul lato interno).
In confronto a quella dei lipidi la mobilità laterale delle proteine è di gran lunga inferiore.
3. Metodi d'analisi.
a) Misure di flusso.
La misura dei flussi di materia attraverso le membrane rappresenta un fondamentale metodo di analisi. Per calcolare il flusso, cioè la quantità di una sostanza che viene trasportata nell'unità di tempo attraverso la superficie della membrana, dobbiamo misurare la variazione della concentrazione ditale sostanza nel volume attiguo alla membrana in funzione del tempo. Se il volume varia, si deve allora applicare una correzione che prenda in considerazione la variazione di volume in funzione del tempo. Per effettuare queste misure, si pongono membrane di dimensioni abbastanza grandi a separare due semicelle e si determina l'andamento nel tempo della variazione di concentrazione nelle fasi esterne tramite continui prelievi di campioni o tramite continue e dirette analisi fotometriche o elettriche del liquido contenuto nella cella. Per evitare che insorgano differenze di concentrazione nelle fasi esterne, queste devono venire mescolate continuamente ed energicamente da appropriati agitatori. Se si misura il trasporto attraverso membrane cellulari di sospensioni di cellule, vescicole di membrana o liposomi (questi sono microscopiche vescicole ripiene di liquido, costituite da un doppio strato lipidico che si ottengono sottoponendo le emulsioni lipidiche a ultrasuoni e che servono a caratterizzare il tipo di trasporto in membrane lipidiche artificiali), si può misurare la variazione di concentrazione della fase esterna con l'aiuto di elettrodi selettivi, oppure si può seguire l'andamento della concentrazione all'interno delle cellule o delle vescicole separandole rapidamente (a tempi prestabiliti) dalla fase esterna tramite filtrazione o centrifugazione e determinando poi la massa totale della sostanza in esame sul filtro o nel sedimento. Per misurare la concentrazione viene spesso aggiunta alle fasi una piccola dose di sostanza marcata con un isotopo radioattivo (il cosiddetto ‛tracciante'). Qualora l'attività specifica della sostanza che ci interessa (cioè il rapporto tra le concentrazioni del componente marcato e di quello non marcato) sia ovunque costante nel sistema, allora il flusso del tracciante puo essere considerato come parametro di misura del flusso netto anche del componente non radioattivo; se si divide il flusso del tracciante per l'attività specifica, si ottiene il flusso netto. Questo metodo permette di misurare flussi di sostanza estremamente piccoli, per i quali non esistono metodi di determinazione chimica sufficientemente sensibili. Se tuttavia il tracciante viene aggiunto al liquido solo da un lato della membrana allora si misurano i cosiddetti flussi unidirezionali, la cui interpretazione è però complicata dall'abbinamento col flusso del tracciante. Il gradiente di attività specifica rappresenta, in esperimenti di questo tipo, una forza termodinamica indipendente accanto al gradiente chimico della componente non marcata. Le permeabilità misurate per mezzo dei traccianti risultano identiche alla permeabilità della componente non marcata solo quando le interazioni col flusso di tracciante sono trascurabili come nelle soluzioni acquose diluite (v. cap. 4, È b). Interazioni con un flusso di tracciante sono state spesso osservate nel trasporto di molecole non solo attraverso membrane biologiche, ma anche attraverso membrane artificiali.
Il modo migliore per determinare il flusso d'acqua consiste nel determinare le variazioni volumetriche. Il contributo di ioni o di non elettroliti nei flussi volumetrici dei sistemi biologici è di regola trascurabile a causa della loro forte diluizione. Come marcante per determinare i flussi volumetrici si aggiungono spesso nelle fasi esterne, in piccola concentrazione, molecole marcate che non possono penetrare la membrana a causa della loro grandezza (per es.: inulina, un polifruttano con peso molecolare di circa 5.500). Dalla variazione della concentrazione del marcante si riesce a calcolare direttamente il flusso volumetrico.
Si deve tenere presente, durante la misurazione e l'interpretazione dei flussi ionici, che deve essere mantenuta la condizione di elettroneutralità (lo stesso numero di cariche positive e negative in ogni fase). Può accadere che il flusso di uno ione sia infinitamente piccolo o nullo, malgrado siano in gioco elevate differenze di potenziale elettrochimico ed elevata permeabilità; ciò avviene quando nessun altro ione può attraversare la membrana oppure quando la elettroneutralità non può essere mantenuta mediante il flusso di ioni dagli elettrodi (v. cap. 4, È d).
b) Misure elettriche.
I liquidi biologici sono costituiti principalmente da soluzioni acquose di elettroliti (ioni) ed è per questo motivo che nel trasporto attraverso membrane biologiche compaiono fenomeni elettrici come potenziali di membrana e trasporto di cariche elettriche (corrente elettrica). Per questa ragione, il campo dei metodi d'analisi si amplia notevolmente.
Il potenziale di membrana può essere usato per misurare le proprietà della membrana, in quanto esso dipende dai gradienti di concentrazione di elettroliti e non elettroliti e dal metabolismo, e inoltre può essere cambiato da una corrente di transmembrana imposta dall'esterno. Per la misura del potenziale di membrana di singole cellule si utilizzano normalmente i cosiddetti microelettrodi. Questi sono capillari di vetro, che vengono riempiti con una soluzione molto concentrata di cloruro di potassio. Se la punta di questi elettrodi ha diametro inferiore a i millesimo di mm (circa 0,2 μm), può essere inserita all'interno di singole cellule, senza mettere in cortocircuito la membrana (v. fig. 8). Con l'aiuto di un elettrometro ad alta impedenza d'ingresso è possibile poi misurare il potenziale di membrana tra l'elettrodo intracellulare e quello extracellulare (costruito analogamente). Dato che gli elettrodi vengono riempiti con una soluzione molto concentrata di un sale il cui catione e anione hanno la stessa mobilità, non si riscontrano ai confini delle fasi (soluzione di KCl degli elettrodi contro citoplasma o liquido extracellulare) potenziali di diffusione interferenti. I potenziali di membrana di cellule, di organelli subcellulari, di vescicole di membrana o di liposomi, in cui non si possono inserire i microelettrodi, vengono oggi misurati con l'aiuto di determinati coloranti fluorescenti che si distribuiscono tra la fase esterna e quella interna in dipendenza dalla differenza di potenziale.
Oltre alla semplice misura del potenziale, esistono numerosi altri metodi elettrofisiologici per particolari misure.
1. Preselezione del voltaggio (voltage clamp). Con questa tecnica viene misurata quella corrente che è necessaria per mantenere il potenziale di membrana costante a un determinato valore con l'aiuto di un circuito capace di controreagire. Grazie alla dipendenza delle correnti dal potenziale e dalla concentrazione, si è riusciti a identificare i flussi ionici che prendono parte al fenomeno dell'eccitamento nervoso (v. elettrofisiologia e neurone e impulso nervoso).
2. La misura della corrente di cortocircuito rappresenta un caso particolare della tecnica della preselezione del voltaggio. Con questa tecnica viene misurata quella corrente che è necessaria per fissare il potenziale di membrana a zero. In molti epiteli questa corrente di cortocircuito è una misura diretta per il trasporto attivo di sodio.
3. Analizzando le correnti di membrana (per es. la corrente di cortocircuito) con un'elevata sensibilità e con elevata risoluzione, si trovano, di regola, piccole oscillazioni di corrente dovute alla presenza di ‛pori' o ‛canali' che si chiudono e aprono spontaneamente nella membrana. Dagli spettri di frequenza dell'oscillazione della corrente si possono rilevare, in casi favorevoli, il numero e il tempo medio di apertura dei canali.
4. Se si applicano a una membrana cellulare elettrodi smussati, in modo tale che l'elettrodo isoli dall'ambiente circostante una frazione di 1 micrometro quadrato della membrana (patch clamp), si può osservare attraverso l'elettrodo il flusso di corrente di singoli canali (v. cap. 5, È a, 1).
5. Se si riempiono i microelettrodi, invece che con una soluzione di KCl, con resine a scambio ionico selettive per una specie ionica (per es. per Na+ o per Cl-), e si inseririscono questi elettrodi in singole cellule, si può determinare l'attività intracellulare della rispettiva specie ionica e calcolare la concentrazione ionica del citoplasma conoscendo il potenziale elettrico di membrana.
c) Altre tecniche analitiche.
Lo studio mediante le tecniche della microscopia elettronica è essenziale soprattutto per l'analisi dell'ultrastruttura di singole membrane cellulari, così come della costituzione di membrane composte, quali per es. gli epiteli (in quest'ultimo caso ha notevole importanza la tecnica del criodecapaggio). La microscopia elettronica è stata però anche utilizzata per l'analisi di concentrazioni ioniche intracellulari (microsonda a raggi elettronici).
I metodi biochimici vengono usati per determinare la composizione delle membrane e per isolarne i singoli componenti, come pure per arricchire l'analisi strutturale.
I metodi spettroscopici, come la misura della risonanza nucleare e della risonanza di spin elettronico, vengono utilizzati per studiare la struttura e lo stato del materiale di membrana.
4. Descrizione teorica dei fenomeni di trasporto (teoria fenomenologica del trasporto attraverso membrana).
a) Premesse, deduzioni, asserzioni generali.
Tutte le analisi del trasporto hanno lo scopo finale di comprenderne il meccanismo molecolare e di descrivere quantitativamente, sulla base di leggi fisiche, i flussi osservati. Agli inizi delle ricerche sulle membrane, simili tentativi di descrizione quantitativa si basavano su modelli di membrana molto specifici o su semplici supposizioni che non permettevano una completa descrizione di tutti i fenomeni più importanti e per vari motivi non erano pienamente soddisfacenti.
Questo vale, per esempio, per il modello a pori di Renkin e Pappenheimer (v., 1957), che si basa sulla supposizione, non dimostrata, che i flussi attraverso i pori microscopici della membrana ubbidiscano alle stesse leggi dei flussi attraverso tubature macroscopiche (legge di Hagen e Poiseuille). E vale anche per i modelli di membrane biologiche o artificiali proposti da Teoreli (v., 1935), Meyer e Sievers (v., 1936) e da Schlögl (v., 1964), il cui parametro essenziale, la densità delle cariche fisse nel liquido dei pori, è per lo meno non accessibile a una misurazione sperimentale. E vale altresi per la formulazione semiempirica delle correnti ioniche in dipendenza dai gradienti di potenziale e di concentrazione, secondo Goldman (v., 1943) e Hodgkin e Katz (v., 1949), che si basa sulla supposizione, anche in questo caso non dimostrata, di un gradiente lineare elettrico all'interno della membrana. Tuttavia, è possibile basarsi su una serie di condizioni generali valide che si deducono da osservazioni termodinaniche e a cui soggiacciono tutti i fenomeni di trasporto della membrana. Queste condizioni sono contenute nella teoria fenomenologica del trasporto di membrana (v. Stavermann, 1952; v. Kedem e Katchalsky, 1958; v. Sauer, 1973), grazie alla quale è possibile classificare e mettere in relazione reciproca tutti i fenomeni di trasporto. Il punto di partenza è rappresentato dalla termodinamica dei processi irreversibili (termodinamica del non equilibrio). Essa non considera le caratteristiche della membrana, ma piuttosto lo stato termodinamico degli ambienti liquidi che sono divisi dalla membrana.
Sembra opportuno, pertanto, passare brevemente in rassegna i presupposti e le conclusioni della teoria fenomenologica. Prendiamo dapprima in considerazione una struttura sperimentale idealizzata (v. fig. 9), in cui una membrana (*) separa due ambienti esterni (fase ′ e fase ″), e ammettiamo che le fasi ′ e ″ contengano una serie di sostanze alle quali la membrana è permeabile e che noi numereremo da i=1 a i=w (w=acqua). Le fasi devono essere omogenee (cioè agitate costantemente, cosicché non nascano differenze di concentrazione al loro interno) e tutto il sistema deve essere chiuso verso l'esterno, ma essere in contatto, attraverso pareti permeabili al calore, con un bagno di acqua a temperatura costante, in modo che non possano sorgere differenze di temperatura all'interno del sistema. Se le fasi hanno la stessa composizione e la pressione idrostatica è ovunque uguale, allora il sistema si trova in equilibrio interno: i potenziali chimici μi di tutte le sostanze sono ovunque costanti e tra le fasi ′ e ″ non ci sono differenze di potenziale e non c'è alcun flusso netto attraverso la membrana. Se tuttavia la composizione delle fasi è differente, allora il sistema tenderà all'equilibrio, in quanto si stabiliscono dei trasporti di materiale attraverso la membrana finché è raggiunto l'equilibrio. Questi sono processi irreversibili che sono connessi, secondo il II principio della termodinamica, con un incremento dell'entropia interna del sistema. La variazione dell'entropia in funzione del tempo dSin/dt viene così descritta:
Essa è necessariamente positiva. Nell'equazione (1) i simboli Ji descrivono il flusso delle sostanze i (moli/tempo) dalla fase ′ alla fase ″, che può essere calcolato dalla variazione del numero di moli (ni) nelle fasi esterne
e i simboli Δμi indicano le differenze (Δ=′−″) dei potenziali chimici delle sostanze i tra le fasi ′ e ″. Esse hanno le dimensioni di joule/mole e si calcolano dalle concentrazioni nel seguente modo:
dove R rappresenta la costante dei gas (8,31 joule/grado), T la temperatura assoluta (in gradi Kelvin), ln il logaritmo naturale e ci′ e ci″ la concentrazione della sostanza i nella fase ′ e nella fase ″. Quando il sistema, che viene considerato come rappresentativo di un gran numero di membrane di qualsiasi tipo, si trova già vicino all'equilibrio, ci si può aspettare che i flussi, attraverso i quali il sistema tende all'equilibrio definitivo, obbediscano alle seguenti equazioni:
cioè tutti i flussi Ji possono essere stimolati da tutte le forze termodinamiche in gioco. In relazione alle caratteristiche della membrana, il flusso Ji dipende dalla sua forza coniugata Δμi o da un'altra forza Δμj (j=1 ... w, j≠i) o, eventualmente, una simile dipendenza può non esistere affatto. Le equazioni (4) significano per il momento solo che all'inizio sono possibili tutte queste dipendenze.
I coefficienti Lij (i,j=1 ... w) vengono chiamati coefficienti fenomenologici. In matematica sono definiti come derivate parziali dei flussi Ji rispetto ai Δμi.
Per esempio
Come risulta dall'equazione (5), si possono calcolare i coefficienti fenomenologici dalla variazione di un flusso ∂Ji osservata in risposta a una precedente variazione della differenza di potenziale ∂ Δμi. I coefficienti L vengono spesso definiti come coefficienti di conducibilità, dato che indicano, analogamente alla definizione di conduttività nella legge di Ohm, il flusso come funzione di un potenziale induttore. Se si sono definiti tutti i coefficienti Lij del le equazioni (4) di un sistema dato, allora si è descritto pienamente il comportamento del flusso di questo sistema vicino all'equilibrio. Con questo non si ha però ancora alcuna idea del meccanismo di trasporto, dato che la grandezza dei singoli coefficienti non viene solo determinata dalle proprietà della membrana, ma anche dalla condizione (stato di riferimento) del sistema totale, cioè dal numero e dalla concentrazione media dei singoli componenti del sistema totale, così come dalla temperatura. Solo quando si conosce la dipendenza di Lij dallo stato di riferimento e si effettuano eventualmente degli esperimenti di confronto con altre sostanze i, oppure si estendono le analisi al campo non lineare del sistema, è possibile confrontare le osservazioni con le considerazioni sul modello e da qui trarre le conclusioni sui meccanismi di base del trasporto. A questo punto dell'analisi è naturalmente anche necessario ottenere informazioni sulla struttura della membrana per poterle prendere in considerazione nella formulazione di un modello. In un primo momento può sembrare che questa via conduca all'infinito, e ci si potrebbe chiedere se la teoria fenomenologica offra realmente un vantaggio oppure se complica solo l'analisi. Bisogna ribattere che in realtà non esiste una alternativa, e che tutte le nozioni finora ottenute sui fenomeni di trasporto attraverso le membrane sono derivate da misurazioni che fanno parte dei procedimenti sopra descritti.
A differenza dal procedere sistematico della teoria fenomenologica, si sono però finora analizzati e rappresentati per lo più solo gli aspetti parziali, contro la qual cosa, in linea di principio, non c'è nulla da obiettare da un punto di vista empirico. L'impostazione sistematica della teoria fenomenologica ci dovrebbe invece aiutare a costruire dei modelli senza pregiudizi al fine di evitare conclusioni errate. Tale teoria ci fornisce inoltre alcune importanti relazioni quantitative e alcune limitazioni, che non derivano direttamente da osservazioni meccaniche dei modelli (e che per questa ragione potrebbero essere facilmente e inconsapevolmente violate). A ciò si riferiscono innanzitutto le relazioni di Onsager, per le quali la dipendenza parziale dei flussi dalle forze in vicinanza dell'equilibrio è indice della presenza di simmetrie, che portano al risultato
Lij=Lji (i≠j), (6)
cioè per esempio L12 deve essere tanto grande quanto L21. Con ciò si riduce considerevolmente il numero delle misure indipendenti; ad esempio, per un sistema con componenti permeabili w, da w2 a ½w(w+1). Segue poi da dati di fatto che la produzione di entropia deve essere sempre positiva, che i coefficienti diretti Lii, cioè L11, L22, ..., Lww, devono essere positivi, mentre i coefficienti crociati Lij (j≠i) possono essere in linea di massima positivi o negativi e infine segue che
Lii Ljj≥L²ij. (7)
Questo significa che la teoria fenomenologica ci fornisce una serie di condizioni importanti, che devono essere rispettate in ogni esperimento, in modo tale che si possano realizzare misure corrette, e devono essere tenute presenti durante il calcolo dei modelli.
b) Importanza dei coefficienti fenomenologici.
I coefficienti diretti Lii (i=1 ... w) sono strettamente connessi col concetto tradizionale di permeabilità, ma non si identificano con esso. Se noi misuriamo, per es., il J1 in funzione di Δμ1 e se manteniamo costante Δμj (j=2, ... w), l'equazione (4a) si riduce a
Vicino all'equilibrio (quando ci′ e ci″ differiscono solo di poco) si può sostituire con ottima approssimazione l'espressione ln ci′/ci″ con il termine matematico equivalente Δci/åi, dove åi rappresenta la concentrazione media di i in ambedue le fasi:
L'equazione (12) indica la relazione esistente tra il coefficiente diretto Lii e il coefficiente di permeabilità Pi, come viene utilizzato di solito.
Si vede che il primo termine dell'equazione (4a) descrive la ‛parte diffusionale' del flusso totale. Analogamente con l'equazione (12) si può definire la permeabilità dell'acqua:
Le misure di permeabilità vengono spesso effettuate con sostanze marcate con isotopi radioattivi (i cosiddetti traccianti). In questo caso bisogna tenere però presente che la permeabilità del tracciante (Pi*), così determinata, è identica alla vera permeabilità (Pi) solo quando non esiste alcun accoppiamento di flusso con il tracciante, cioè quando L*0=0. Nel caso in cui L*0≠0 vale la relazione
dove ρ- è l'attività specifica media dei componenti marcati e L*0 rappresenta il coefficiente fenomenologico che esprime la dipendenza del flusso dei componenti marcati (*) dalla differenza di potenziale chimico dei componenti non marcati (0) della sostanza i (per la derivazione dell'equazione 13, v. Sauer, 1973).
Per i ‛coefficienti crociati' Lij (i≠j) e per i componenti del flusso che si ricavano da essi non esiste alcuna denominazione tradizionale. Con l'aiuto del coefficiente L12 descriviamo, per esempio, quella parte del flusso J1 che viene sospinta dalla forza agente della componente 2:
In questo caso si ha a che fare con un fenomeno di accoppiamento di flussi, che non venne preso in considerazione agli inizi della ricerca sui trasporti e che non è considerato nei classici concetti dell'equazione dei flussi di Nernst-Planck. Accoppiamenti di flussi sono stati tuttavia recentemente osservati in membrane artificiali e soprattutto in quelle biologiche.
I coefficienti crociati Liw e rispettivamente Lwi (i=1 ... (w−1)) descrivono l'accoppiamento tra acqua e particelle libere. Questo accoppiamento (solvent drag) è conosciuto già da lungo tempo. Esso viene descritto con l'aiuto del coefficiente di riflessione (v. Stavermann, 1952). Partendo dalla (4c) possiamo scrivere per il flusso d'acqua
Abbiamo derivato i coefficienti di riflessione σi (i=1 ... (w−1)) dal coefficiente L come segue (per la derivazione, v. Sauer, 1973):
Il coefficiente di riflessione indica l'attività osmotica di una sostanza libera; σi=0 significa che la sostanza è osmoticamente inefficace: le differenze di concentrazione della sostanza i tra la fase ′ e la fase ″ non causano alcun flusso di acqua; σi=1 significa che il soluto sviluppa la stessa attività osmotica di una sostanza per la quale la membrana è assolutamente impermeabile.
c) Trasporto attivo.
Il sistema discusso finora non consente la descrizione di tutti i piu importanti fenomeni di trasporto attraverso membrane biologiche. Qualora tutte le forze motrici siano Δμi=0 (i=1 ... w), si dovrebbe avere dalle equazioni (4) che anche tutti i flussi dovrebbero diventare Ji=0 (i=1 .. w). Invece, nei sistemi biologici si osserva che possono essere presenti attraverso la membrana significativi flussi netti Ji anche quando sono scomparse tutte le forze motrici Δμi (incluse tutte le differenze di pressione). Questi flussi vengono sostenuti dall'energia metabolica e si definiscono ‛trasporti attivi'. Se si blocca il metabolismo, per esempio impedendo l'afflusso di ossigeno o somministrando veleni metabolici, allora si blocca anche il trasporto attivo. Ne concludiamo che nelle membrane biologiche si verificano accoppiamenti tra flussi di transmembrana e reazioni chimiche. Dal punto di vista puramente formale possiamo capire questo accoppiamento se introduciamo nell'equazione dell'entropia un altro processo dissipativo:
dove Jr rappresenta la velocità della trasformazione chimica e A l'affinità della reazione, che si calcola come forza motrice della reazione dai coefficienti stechiometrici e dai potenziali chimici dei prodotti iniziali e finali della reazione.
Nell'equazione (17) ammettiamo che le sostanze partecipanti alla reazione non appartengano alle sostanze permeanti (i=1 ... w), oppure che non possano attraversare la membrana, perché altrimenti dovremmo tener conto anche del loro flusso di transmembrana, cosa che complicherebbe la trattazione. Immaginiamo, perciò, che le sostanze partecipanti alla reazione possano avvicinarsi alla membrana soltanto dalla fase ′ e che anche i prodotti possano retrodiffondere solo nella fase ′. Per questo motivo abbiamo utilizzato, nell'equazione (17), A′ al posto di A. Con questa rappresentazione ci avviciniamo molto, del resto, alle condizioni reali della membrana cellulare.
Grazie all'introduzione dei processi dissipativi supplementari, le equazioni del flusso vicino all'equilibrio si estendono:
Come si può notare, otteniamo in questo modo un nuovo termine di flusso, che interpretiamo come contributo del trasporto attivo Jiact al trasporto netto:
Si osservi che Jr non rappresenta alcun flusso attraverso la membrana, e che non viene definito dall'equazione (2). Il fatto che il trasporto attivo abbia una direzione e cambi polarità cambiando l'orientamento della membrana indica che dobbiamo trovarci davanti a una membrana asimmetrica.
Il trasporto attivo può anche essere ricostruito in un sistema di membrane artificiali. Kepes e Selegny hanno rispettivamente proposto e realizzato un simile sistema: si ha una membrana costituita complessivamente da 3 strati disposti uno dietro l'altro, così da formare nel mezzo due spazi intermembranali (*) e (**), disposti uno dietro l'altro (v. fig. 10). Se nelle fasi esterne si mettono glucosio, ATP, ADP e fosfato, nello spazio (*) l'enzima esochinasi, e nello spazio (**) l'enzima fosfatasi, allora si può osservare un trasporto attivo di glucosio dalla fase ′ alla fase ″ dipendente dalla concentrazione di ATP: nel compartimento di membrana (*) viene formato in continuazione glucosio-6-fosfato che può diffondere nello spazio (**), nel quale viene di nuovo liberato glucosio, che diffonde poi nella fase ″. L'asimmetria della membrana, sede del trasporto attivo, viene realizzata in questo modello con l'aggiunta asimmetrica dell'enzima in ambedue gli spazi intermembranali.
Il trasporto attivo di una componente può aver luogo in sistemi di membrana eterogenei, come per esempio in membrane epiteliali, che sono costituite da almeno due diverse membrane poste l'una dietro l'altra, anche nel caso in cui in nessuna delle singole membrane esista un diretto accoppiamento di flusso della componente i con una reazione chimica. Questo è sempre possibile quando un'altra componente, j≠i, viene trasportata attivamente in una delle membrane parziali e quando esiste un meccanismo passivo di accoppiamento del flusso tra i e j con Lij≠0 in una delle membrane parziali. Il flusso attivo di i viene poi prodotto dall'accoppiamento del flusso della componente i con il flusso attivo della componente j. In questo caso parliamo di trasporto attivo secondario della componente i (v. fig. 11; per la definizione, v. Frömter, 1977). Il trasporto attivo secondario ha molta importanza nei fenomeni di trasporto negli epiteli.
d) Sistemi con elettroliti.
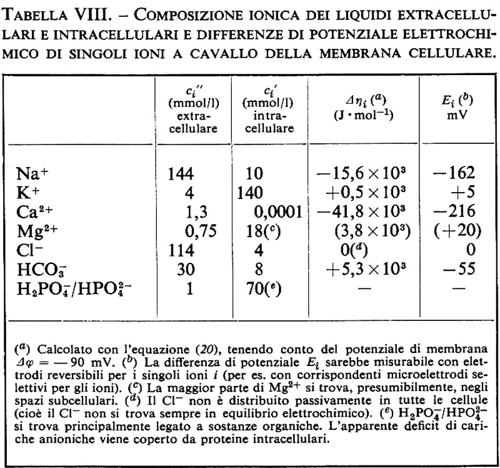
1. Differenza di potenziale elettrico e corrente elettrica. - La trattazione dei sistemi che contengono ioni non differisce molto dai processi finora descritti nei sistemi non elettrolitici, ma presenta alcuni aspetti addizionali. La forza motrice per il flusso ionico non dipende dalla differenza di potenziale chimico Δμi, ma dalla differenza di potenziale elettrochimico Δηi:
Δηi=Δμi+ziF Δϕ. (20)
Il movimento degli ioni non è dovuto solo alla differenza di concentrazione e perciò al Δμi, ma anche alla differenza di potenziale elettrico Δϕ, grazie alla loro carica elettrica ziF (zi è la valenza ed F è la costante di Faraday = 96.500 coulomb/mole). Sebbene Δϕ non possa essere definito esattamente dal punto di vista termodinamico (perché i potenziali chimici dei singoli ioni non possono essere misurati esattamente), la separazione di Δηi nella parte chimica e in quella elettrica si è dimostrata in pratica molto utile. Δηi può essere determinato direttamente grazie all'aiuto di un paio di elettrodi, reversibili per lo ione i (per esempio un filo di Ag per gli ioni Ag+ oppure un filo d'argento ricoperto di AgCl per gli ioni Cl-). La tensione Ei così rilevata è allora uguale a Δηi/ziF. La differenza di potenziale Δϕ può invece essere determinata solo approssimativamente e cioè nel migliore dei casi con un paio di elettrodi a calomelano, collegati mediante ponti di KCl concentrato (v. cap. 3, È b) alla soluzione diluita rispettivamente della fase ′ e della fase ″. Vicino all'equilibrio otteniamo in questo caso le seguenti equazioni di flusso, in cui i rappresenta di nuovo tutte le componenti permeabili, ma dove per i non elettroliti vale zi=0:
Se si introduce rispettivamente nelle fasi ′ e ″ un ulteriore paio di elettrodi, si può convogliare una corrente nel sistema, senza avere problemi tecnici di misura per la determinazione di Δϕ. Per limitare il più possibile gli spostamenti di acqua e di ioni presso gli elettrodi, si utilizzano, preferibilmente, per la immissione della corrente, elettrodi reversibili per uno ione, come per esempio i sopra menzionati elettrodi Ag/AgCl, che lasciano passare attraverso la superficie degli elettrodi solo flussi di ioni cloro. All'interno del sistema il circuito elettrico viene chiuso dal trasporto netto di cariche attraverso la membrana. La corrente I è allora identica alla somma di tutti i movimenti di cariche:
I=z1FJ1+z2FJ2+...+zwFJw (22)
o, scritto in forma abbreviata (dove Σ indica la sommatoria):
(si osservi che z per i non elettroliti è uguale a zero, cioè per esempio zw=0, cosicché in realtà solo i trasporti ionici contribuiscono alla formazione del flusso di corrente). Tuttavia, il flusso di corrente ha come conseguenza il fatto che l'equazione (2) non è più valida per lo ione n verso il quale la coppia di elettrodi, usati per immettere corrente, è reversibile. Invece dell'equazione (2) otteniamo, per questo ione,
2. Proprietà delle membrane misurabili con metodi elettrici. - Al passaggio della corrente, la differenza di potenziale Δϕ a cavallo della membrana varia in relazione alla conduttanza elettrica g
Dalle equazioni (21), (22) e (23) si può derivare la conduttanza elettrica come somma di tutti i coefficienti
Quella parte della corrente che viene trasportata da un'unica specie ionica viene descritta dal cosiddetto numero di trasporto ti
Contrariamente a g, gi non si può misurare direttamente, tranne che in quei rari casi in cui gi non varia, cioè quando si sostituiscono tutti gli altri ioni con ioni che non permeano. Pertanto, di solito si misura g e si determina ti dalla dipendenza del potenziale di membrana dalle variazioni di concentrazione ionica, ottenute sostituendo una parte degli ioni i con ioni con carica uguale che non permeano. Anche quando dall'esterno non viene inviata alcuna corrente (I=0) attraverso la membrana, può essere presente un potenziale di membrana Δϕ≠0. Questo potenziale di membrana insorge o a causa di concentrazioni saline diverse fra le due fasi ′ e ″ (potenziale di diffusione)
o a causa di differenti concentrazioni di non elettroliti, che portano a flussi di acqua (potenziale di flusso; rinunciamo qui alla corrispondente formulazione), oppure infine può essere dovuto alla presenza di un trasporto attivo (potenziale di trasporto attivo)
dove ziFJiact=ziFLiAA′ rappresenta il trasporto di cariche tramite il trasporto attivo. Se si compensa il potenziale di trasporto ‛attivo' tramite l'immissione di una corrente elettrica, si ha la cosiddetta corrente di cortocircuito
che rappresenta il trasporto netto di cariche dovuto alla somma di tutti i flussi ionici ‛attivi'. Nel caso in cui venga trasportata attivamente solo una specie ionica (come per esempio nel caso della pelle di rana, che trasporta attivamente solo l'Na+) la corrente di cortocircuito è una misura diretta del trasporto attivo. Se invece vengono trasportati attivamente, nella stessa direzione, cationi e anioni, allora la corrente di cortocircuito rappresenta solo la differenza dei flussi attivi di cariche.
3. Coefficienti crociati minimi e massimi. - A conclusione di questo capitolo si richiama l'attenzione sull'importanza dei coefficienti crociati per i flussi ionici. Se tutti i coefficienti crociati Lij (i=1 ... w, i≠j) sono trascurabili, allora dall'equazione (26) segue che
gi=z²iF2Lii (1=1 ... w) (30)
e considerando la permeabilità (v. eq. 12) si ha poi che
Questa equazione indica la relazione esistente tra la permeabilità e la conduttanza parziale. Essa vale solo nel caso in cui tutti i coefficienti Lij sia no trascurabili, il che è però più un'eccezione che una regola per le membrane biologiche. Se d'altra parte si tratta di un sistema semplice, con solo un sale uni-univalente (per es. NaCl) e se si ammette che ambedue i coefficienti diretti L++ e L-- siano uguali in valore assoluto, allora L+- può diventare al massimo uguale a L++ e al minimo uguale a −L++ o rispettivamente −L--. Nel primo caso saremmo in presenza di un flusso di sale elettricamente neutro (i gradienti di concentrazione non causano potenziali di diffusione attraverso la membrana) e nel secondo caso non diffonderebbe assolutamente alcun sale nonostante la presenza di un gradiente di concentrazione favorevole attraverso la membrana.
5. Fenomeni di trasporto attraverso le membrane biologiche.
In questo capitolo vogliamo discutere i singoli fenomeni di trasporto attraverso le membrane biologiche, e discutere, nei limiti del possibile, le attuali concezioni dei meccanismi che stanno alla base dei trasporti. Per ragioni di spazio, ci dobbiamo limitare a scegliere i singoli fenomeni più o meno arbitrariamente. Tuttavia per riuscire a ottenere ugualmente un quadro generale, seguiremo i criteri osservati nel precedente capitolo, che riguardava la discussione della teoria fenomenologica dei trasporti attraverso le membrane. Tratteremo innanzi tutto i trasporti per membrana che possono essere riuniti sotto il concetto generale della diffusione e che vengono descritti nella teoria fenomenologica tramite il cosiddetto coefficiente diretto Lii; poi ci occuperemo dei fenomeni d'accoppiamento tra i flussi di diverse componenti, che vengono descritti tramite i cosiddetti coefficienti crociati Lij (i=j), e infine discuteremo del trasporto attivo, che si instaura tramite l'accoppiamento del flusso di un componente con una reazione chimica e che può essere spiegato grazie a un coefficiente LiA.
a) Trasporto per diffusione.
In questo paragrafo vengono considerati quei fenomeni di trasporto che possono essere caratterizzati da un coefficiente diretto Lii; si tratta di flussi di una componente i che si generano spontaneamente grazie alla loro forza coniugata, cioè alla differenza di potenziale rispettivamente chimico ed elettrochimico della componente i. L'equazione (12) descrive come al solito il rapporto tra il flusso e la forza motrice tramite il coefficiente di permeabilità (Pi), che esprime la permeabilità della membrana per la componente i e che dipende dalla concentrazione in grado minore del coefficiente Lii. La grandezza di un coefficiente di permeabilità non può portare da sola ad alcuna conclusione sul meccanismo di permeazione. Per avere un'idea del meccanismo molecolare di permeazione, si deve determinare la dipendenza del coefficiente dai parametri del sistema (quali la concentrazione di tutti i componenti, la pressione e la temperatura) e determinare la dipendenza del coefficiente dalle proprietà della particella permeante (peso molecolare, forma molecolare, struttura chimica delle catene laterali, carica ecc.) e dalle proprietà della membrana (variazioni della composizione lipidica, delle catene laterali delle proteine, della carica ecc.). Come viene indicato qui di seguito, si possono distinguere, in base a queste misure, almeno due tipi di permeazione, che vengono definiti ‛diffusione semplice' e ‛diffusione facilitata'.
1. Diffusione ‛semplice' dei non elettroliti. - Il modello base della permeabilità della membrana cellulare per i non elettroliti è dovuto principalmente alle numerose ricerche di Collander e collaboratori effettuate soprattutto sull'alga Nitella. La fig. 12 riporta i coefficienti di permeabilità della membrana cellulare di quest'alga per 57 diverse sostanze con pesi molecolari compresi tra 19 e 480. Essi sono riportati in funzione dei coefficienti di ripartizione olio d'oliva/acqua. Come si vede, la permeabilità aumenta con l'aumentare della solubilità delle sostanze nei lipidi e diminuisce col crescere del peso molecolare: le sostanze con pesi molecolari 〈60 si raggruppano sul lato sinistro della distribuzione e le sostanze con pesi molecolari >150 sul lato destro. La dipendenza dal peso molecolare è però relativamente piccola. Da questi dati, che sono convalidati da analoghi risultati ottenuti in altre membrane cellulari (cellule epiteliali, globuli rossi), si può concludere: a) che la membrana cellulare si comporta come una barriera di lipidi, cioè che la permeazione viene determinata essenzialmente dalle forze che determinano anche la ripartizione tra lipidi e acqua; b) che la membrana cellulare funziona da barriera diffusionale, la quale lascia passare più difficilmente le molecole più grosse rispetto a quelle più piccole.
Questi risultati si spiegano facilmente con un modello di diffusione semplice, dividendo la permeazione in tre momenti distinti: 1) passaggio di una particella dalla soluzione esterna in una fase lipoide della membrana; 2) diffusione attraverso la membrana lipoide; 3) uscita dalla fase della membrana nella soluzione esterna. Se si ammette che i punti 1) e 3) si possano realizzare velocemente, cioè che il passaggio di fase avvenga cosi rapidamente che le superfici della fase della membrana si trovino sempre in equilibrio di ripartizione con le soluzioni esterne confinanti, allora vale la relazione
dove cèi′ e cèi″ indicano le concentrazioni della sostanza i a livello delle superfici della membrana dai lati ′ e ″, rispettivamente, e Ki rappresenta il coefficiente di ripartizione di i tra la fase lipoide della membrana e la soluzione acquosa esterna. Nell'equazione (32) ammettiamo, quindi, che la concentrazione della sostanza i alla superficie della membrana sia più alta di un fattore Ki rispetto alle fasi esterne confinanti. In relazione al concentrarsi della sostanza alle due interfacce, si crea all'interno della membrana un gradiente diffusionale, lungo il quale fluisce la sostanza i attraverso tutta la membrana. In questo caso è prevedibile che il flusso Ji, all'interno della membrana, obbedisca alla legge della diffusione di Fick:
dove Dè i rappresenta il coefficiente di diffusione empirico di i nella fase della membrana e d lo spessore della membrana. Il flusso Ji si riferisce qui all'unità di superficie della membrana. Dalla (32) e dalla (33) segue:
In conformità con i dati sperimentali della fig. 12 troviamo, quindi, che la permeabilità dovrebbe aumentare proporzionalmente al coefficiente di ripartizione membrana/acqua. I coefficienti di ripartizione membrana/acqua non si conoscono, ma, dato che, come sappiamo, la membrana cellulare è costituita soprattutto da lipidi e dato che i valori della ripartizione nei diversi lipidi o solventi dei lipidi differiscono solo di poco, possiamo ammettere che i valori di Ki per olio d'oliva/acqua, che sono descritti nella fig. 12, descrivano con buona approssimazione i rapporti nella membrana. Non si conoscono i coefficienti di diffusione Dè i delle singole sostanze nella fase lipidica, cosicché non si può stabilire definitivamente la validità dell'equazione (35) e perciò l'esattezza della rappresentazione del modello. Sappiamo, però, che i coefficienti di diffusione di diverse sostanze si comportano nelle soluzioni acquose in modo inversamente proporzionale alla radice quadrata o cubica del peso molecolare (v. Stein, 1967). È senz'altro possibile, perciò, che la diminuzione della permeabilità all'aumentare del peso molecolare (v. fig. 12) rispecchi la dipendenza della permeabilità dalle caratteristiche diffusionali dei non elettroliti all'interno della fase della membrana, cosa preannunciata dalla rappresentazione del modello secondo l'equazione (35).
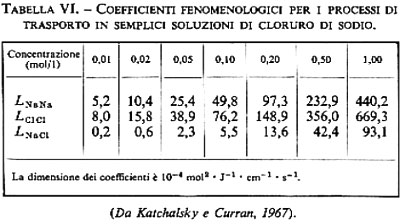
2. Diffusione ‛semplice' degli elettroliti. - La diffusione semplice di ioni inorganici attraverso la membrana cellulare non riveste un ruolo importante. A differenza di quanto accade per i non elettroliti, le forze che interagiscono tra ioni e acqua sono molto più forti di quelle tra ioni e lipidi; di conseguenza gli elettroliti non possono introdursi nella fase lipidica delle membrane in quantità tale da provocare flussi ionici misurabili. Effettivamente i doppi strati lipidici posseggono resistenze elettriche molto alte, sono cioè pochissimo permeabili agli ioni (v. tab. III). Le resistenze elettriche delle membrane cellulari sono invece inferiori di alcuni ordini di grandezza. Questo fa supporre che le membrane cellulari posseggano dei meccanismi specifici che facilitano la permeazione di ioni inorganici (v. sotto, 3, 4 e 5). Sia le membrane cellulari sia i doppi strati lipidici sono invece molto permeabili a ioni organici che posseggano una superficie esterna idrofoba, come per esempio il tetrafenilborato.
Il trasporto di ioni per diffusione semplice esiste in alcune membrane epiteliali (tubulo prossimale del rene, intestino tenue, cistifellea), le quali posseggono vie intercellulari permeabili. Infatti, le membrane cellulari di cellule vicine sono saldate le une alle altre in modo puntiforme, cosicché si formano delle sottili fessure attraverso cui le sostanze possono passare senza superare barriere lipidiche. Le proprietà di alcune di queste fessure somigliano a quelle delle membrane a scambio ionico; sembra infatti che esse siano dovute essenzialmente alla conformazione del reticolo proteico e a un lieve eccesso su questo di cariche negative fisse (v. figg. 13 e 14).
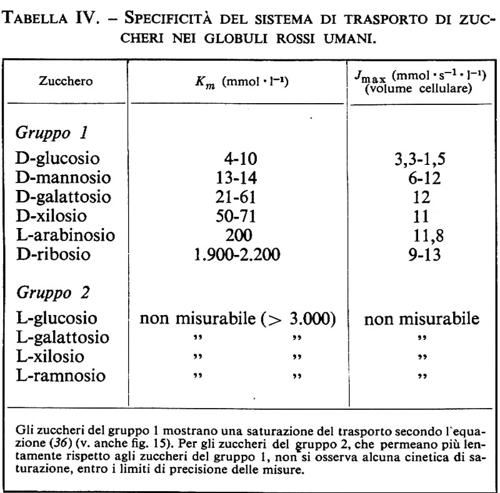
3. Diffusione ‛facilitata' dei non elettroliti. - Se si misura l'assorbimento degli zuccheri nei globuli rossi, si trova che per alcuni zuccheri (per es. D-glucosio) si ha una velocità di trasporto più elevata di quanto ci si aspetterebbe dai dati della fig. 12, mentre per altri, che presentano struttura e caratteristiche fisiche quasi identiche (per es. L-glucosio), non si hanno velocità di trasporto egualmente alte. Da un'analisi più dettagliata del trasporto di zuccheri si sono tratte le seguenti osservazioni.
A. Come nel caso della diffusione libera, il trasporto ha luogo solo in presenza di un gradiente di concentrazione dello zucchero: quando le concentrazioni dello zucchero sono uguali sia all'interno dei globuli rossi sia nella soluzione esterna, il trasporto dello zucchero è nullo. Non si tratta, quindi, di un trasporto attivo, ma di un trasporto passivo.
B. Il coefficiente diretto Lii, che descrive il trasporto di glucosio in funzione della forza motrice Δμi, dipende in modo tipico dalla concentrazione media di glucosio åi. Questa dipendenza viene osservata, per esempio, nelle misure di assorbimento in globuli rossi privati di zuccheri e mostra l'andamento illustrato nella fig. 15. In simili esperimenti si misura l'afflusso di D-glucosio ai globuli rossi (impoveriti di glucosio), a concentrazioni diverse di glucosio, e si pone in relazione il flusso iniziale con la concentrazione di glucosio nella fase esterna. Come si può osservare nella fig. 15, il flusso di glucosio aumenta in proporzione alla concentrazione se questa è bassa, ma a concentrazioni più alte la curva flette e si instaura un trasporto di D-glucosio massimo, che non può essere più aumentato da un ulteriore aumento della sua concentrazione. Questa osservazione indica che ci troviamo di fronte a un sistema di trasporto particolare, che permette - contrariamente alla diffusione semplice - un tipo di trasporto massimale limitato; il trasporto presenta cioè il fenomeno della saturazione. L'andamento della curva nella fig. 15 indica perciò la cinetica di saturazione.
C. L'afflusso del D-glucosio può essere reversibilmente ridotto da concentrazioni molto piccole di fioretina, l'aglucone della florizina, senza che ne risultino disturbate altre funzioni di membrana.
D. Il trasporto di glucosio attraverso la membrana eritrocitaria è in pratica indipendente dalle differenze di potenziale chimico ed elettrochimico di tutte le altre sostanze che si trovano normalmente nel plasma; vale a dire, non insorgono accoppiamenti di flusso tra glucosio e ioni oppure altre sostanze di diversa struttura, parimenti trasportate attraverso la membrana eritrocitaria.
E. Se si misura il trasporto di una serie di sostanze analoghe, come per esempio il D-galattosio (v. tab. IV), si trova che gli zuccheri del gruppo 1 vengono assorbiti negli eritrociti in modo analogo al D-glucosio e che il loro trasporto è saturabile, mentre gli zuccheri del gruppo 2 possono permeare solo molto lentamente ed evidentemente mostrano delle costanti di semisaturazione così alte che non possono più essere determinate esattamente. Il sistema di trasporto ha quindi una spiccata selettività, che comporta un affinità molto elevata per il D-glucosio ed estremamente piccola per gli zuccheri del gruppo 2.
F. Di grande importanza per la formulazione di un modello sono stati i risultati degli esperimenti in cui si sono utilizzati contemporaneamente due zuccheri omologhi.
I) Se si misura l'afflusso di uno zucchero i del gruppo 1 in presenza di uno zucchero j del gruppo 1 si riscontra una riduzione del trasporto rispetto al controllo. In questo caso si parla di inibizione competitiva o cis-inibizione. Questa inibizione insorge indipendentemente dal fatto che j venga posto solo nella fase esterna o con la stessa concentrazione nella fase interna ed esterna. Ne deduciamo che il coefficiente diretto Lii dipende dalla concentrazione media di j, cèii.
II) Se si hanno concentrazioni uguali di uno zucchero i del gruppo 1 all'interno della cellula e nella fase esterna, e si introduce poi improvvisamente nella fase esterna uno zucchero j del gruppo 1, allora lo zucchero j fluisce nella cellula e lo zucchero i viene trasportato all'esterno (controtrasporto, v. fig. 16). Si osserva un fenomeno analogo quando si misura l'efflusso di uno zucchero i (per es. D-glucosio) e improvvisamente si aggiunge alla fase esterna uno zucchero j del gruppo 1 (per es. D-galattosio): viene allora accelerato l'efflusso di glucosio, e al fenomeno si dà il nome di trans-stimolazione. Il controtrasporto e la trans-stimolazione sono dovuti ai coefficienti crociati negativi degli zuccheri del gruppo 1.
III) Osservazioni analoghe a quelle sugli zuccheri omologhi (cis-inibizione, trans-stimolazione e controtrasporto) si possono compiere anche riguardo a zuccheri non marcati del gruppo 1 e a loro componenti marcati con isotopi radioattivi. L'efflusso del tracciante viene inibito dal lato interno tramite zuccheri non marcati (cis-inibizione) e accelerato dal lato esterno tramite zuccheri non marcati (trans-stimolazione). Una differenza di concentrazione dei componenti non marcati sposta dall'equilibrio i componenti marcati (controtrasporto). Gli zuccheri del gruppo 1 presentano quindi coefficienti di accoppiamento con i traccianti negativi (L*0〈0).
Da questi risultati si deve concludere che nella membrana esiste un meccanismo di trasporto specifico, in grado di riconoscere le singole molecole di zucchero e di farle passare attraverso di essa. Finora, però, non si è riusciti a descrivere dettagliatamente come sia costruito e come funzioni tale meccanismo. È certo che si tratta di una molecola proteica (o di un gruppo di molecole proteiche) che possiede un sito affine al D-glucosio e che si può legare alternativamente con gli altri zuccheri del gruppo 1, però con minore affinità. Non è ancora noto il meccanismo mediante il quale lo zucchero viene fatto passare attraverso la membrana. In origine si suppose (v. Osterhout, 1935; v. Wilbrandt e Rosenberg, 1961) che si trattasse di trasporto effettuato per mezzo di una molecola (carrier) capace di diffondere da una parte all'altra della membrana (v. fig. 17). Una molecola che per esempio, quando presenta verso la fase ′ il sito in grado di legare il glucosio, raccoglie dalla fase ′ una molecola di glucosio, poi diffonde attraverso la membrana e, non appena ha raggiunto il limite della fase ″, lascia diffondere il glucosio nella fase ″. La molecola potrebbe poi tornare dal lato ′ della membrana nel suo stato non carico, oppure portare con sé durante il suo ritorno, dalla fase ″ alla fase ′, uno zucchero verso cui è affine, eventualmente presente nella fase ″, per iniziare nuovamente il ciclo di trasporto. Questo semplice schema di carrier è stato analizzato dettagliatamente negli anni sessanta in molteplici modelli matematici e si è riusciti così a dimostrare che in realtà tutti i fenomeni di trasporto osservati fino ad allora potevano essere spiegati facilmente in tal modo. Fra l'altro si formulò la teoria della cinetica di saturazione, che è praticamente identica alla cinetica delle reazioni enzimatiche di Michaelis-Menten
se si mette al posto della velocità di reazione V e della concentrazione del substrato S il flusso Ji e la concentrazione della sostanza nella fase esterna ci′ (ci″=0) e si sostituisce la velocità massima di reazione (Vmax) in condizioni semplificate con il prodotto della concentrazione del carrier nella membrana per la permeabilità della membrana per il carrier; allo stesso modo si interpreta la costante di Michaelis Km come costante di equilibrio della reazione di legame del substrato al carrier (v. Frömter, 1977).
Nonostante il buon accordo tra modello teorico e risultati sperimentali, attualmente si è giunti alla conclusione che, molto probabilmente, non è corretto ritenere che lo zucchero venga trasportato legato a una molecola carrier che diffonde attraverso la membrana. Questo convincimento deriva da esperimenti che dimostrano come sia differente l'affinità del sistema di trasporto per lo stesso zucchero sui lati interno ed esterno della membrana, così come da osservazioni generali sulle relazioni esistenti fra le dimensioni della molecola dello zucchero, le necessarie dimensioni della molecola carrier e lo spessore della membrana.
Pertanto, allo stato attuale delle conoscenze è lecito pensare non tanto alla diffusione di una intera molecola carrier, ma piuttosto al rovesciamento o alla rotazione di un sito di legame all'interno di una proteina trasportatrice, oppure a una variazione conformazionale di una parte di un poro, in modo da mettere in evidenza un sito di legame o sul lato cis o sul lato trans. Un simile modello è rappresentato nella fig. 23 per la diffusione per scambio di ioni cloro. La descrizione matematica di un simile processo di traslocazione è, in linea di massima, identica al modello del carrier finché si tratta di fenomeni di traslocazione che possono essere descritti approssimativamente con cinetiche di tipo semplice.
In natura sono molto diffusi i meccanismi di trasporto che possiedono caratteristiche simili a quelle del trasporto di zuccheri negli eritrociti. Li ritroviamo in quasi tutte le membrane plasmatiche cellulari. Oltre ai meccanismi di trasporto per gli zuccheri, esistono anche quelli per gli amminoacidi (per es. sul lato interstiziale di cellule renali e intestinali) così come per un gran numero di altre sostanze (per es. acidi grassi a catena corta). I tentativi compiuti per isolare tali sistemi di trasporto dalla matrice della membrana sono finora riusciti solo in parte. Nei Batteri, nei quali si può indurre dall'esterno la sintesi ex novo di sistemi di trasporto mediante un substrato, si e riusciti a isolare, con l'aiuto di tecniche di marcatura radioattiva, proteine che legano specificamente i substrati usati per l'induzione (le cosiddette proteine di legame); queste proteine sono state ricavate, per esempio, da batteri gram-negativi, che le contengono nella zona periplasmatica (tra la membrana plasmatica e la parete batterica), dopo averle liberate nel mezzo di incubazione mediante shock osmotico (riduzione repentina della concentrazione osmotica nella fase esterna). Sebbene sia ormai accertato che le proteine di legame prendono parte al trasporto, sembra che esse rappresentino solo una parte del sistema di trasporto.
4. Diffusione ‛facilitata' dell'acqua. - Dato che la permeabilità all'acqua di molte membrane cellulari ha più o meno la stessa entità della permeabilità all'acqua dei doppi strati lipidici artificiali, si deve ammettere che il trasporto d'acqua attraverso le membrane cellulari possa avvenire in massima parte come diffusione semplice attraverso la fase lipidica. D'altra parte ci sono indicazioni dell'esistenza di pori speciali, conduttori d'acqua. Alcune cellule (per es. le cellule delle parti distali del nefrone e della vescica urinaria o della pelle di rana) possono variare in pochi minuti di un fattore 10 o ancora di più la loro permeabilità all'acqua in seguito a stimolazione ormonale. L'aumento della permeabilità all'acqua è legato alla comparsa, nella parete luminale della cellula, di nuove particelle di membrana, che all'osservazione al microscopio elettronico con la tecnica del criodecapaggio appaiono come piccole isole di particelle proteiche (v. fig. 18). Sembra si tratti di canali di membrana o pori che facilitano selettivamente il passaggio di acqua. Il meccanismo del trasporto non è ancora conosciuto nei dettagli.
5. Difusione ‛facilitata' di ioni. - Come è riportato nella tab. III, le resistenze elettriche della membrana cellulare sono inferiori di vari ordini di grandezza rispetto alle resistenze dei doppi strati lipidici artificiali. Ciò lascia supporre che la membrana cellulare possegga speciali meccanismi di trasporto per gli ioni, che ne accelerano il passaggio attraverso la barriera lipidica, similmente al caso degli zuccheri e degli amminoacidi. Infatti, sono state effettuate numerose osservazioni che inducono a ritenere probabile l'esistenza di simili meccanismi facilitanti la diffusione ionica. Ad esempio, le membrane cellulari non sono egualmente permeabili a tutte le specie ioniche presenti, bensì lasciano permeare preferibilmente una specie ionica (come l'Na+ o il K+); la conduttanza della membrana può essere bloccata selettivamente da concentrazioni minime di veleni (come la tetrodotossina) o di farmaci; la conduttanza a Na+ e K+ delle membrane cellulari dei nervi non è costante, bensì può variare nel tempo a seconda dello stato di eccitamento (potenziale d'azione); infine si hanno enormi interazioni tra flussi di traccianti.
Benché questi fenomeni fisiologici siano spiegabili con il modello del carrier diffusibile, in realtà non è detto che sia implicato alcun carrier; tuttavia, il concetto di trasporto ionico mediato da un carrier diffusibile è molto importante non solo nella moderna ricerca, ma anche in natura (per es. come meccanismo d'azione di alcuni veleni).
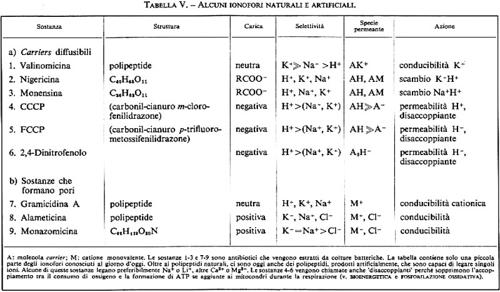
Troviamo un tipico esempio di trasporto facilitato di ioni attraverso carrier diffusibile nel caso degli antibiotici macrociclici come la valinomicina, la nigericina o la monensina (v. tab. V). Si tratta chiaramente di sostanze di ‛offesa', che i singoli ceppi batterici secernono per disturbare le funzioni di membrana di altri esseri viventi. La valinomicina è un cosiddetto depsipeptide (costituito da unità ognuna di tre molecole di L- o D-valina, acido L-lattico e acido D-α-idrossivalerianico) che fu isolato da colture di Streptomyces fulvissimus; tale molecola si può disporre attorno a uno ione potassio a forma di guscio, quindi, grazie alla sua superficie idrofoba, può introdursi nella membrana lipidica, attraversarla e poi lasciare di nuovo libero lo ione potassio dalla parte opposta. Tutto ciò corrisponde esattamente al classico modello di carrier, di cui abbiamo discusso prima (v. fig. 19).
In condizioni fisiologiche, tuttavia, il trasporto di ioni attraverso membrane biologiche è dovuto non a molecole di carrier diffusibili, ma a ‛pori' o ‛canali' permanenti. Sebbene, allo stato attuale delle conoscenze, possa sembrare prematuro introdurre una distinzione sistematica dei diversi tipi di pori, vorremmo tentare una suddivisione provvisoria, distinguendo i pori elettricamente conduttori dai pori non conduttori (pori a scambio ionico). Il primo gruppo (pori elettricamente conduttori) viene suddiviso, poi, in base al meccanismo di apertura, in pori che si aprono e chiudono spontaneamente, in pori controllati chimicamente e in pori controllati dal potenziale elettrico.
α) Pori elettricamente conduttori. La prima dimostrazione plausibile dell'esistenza di canali aperti, o pori, che si estendono da una parte all'altra della membrana e che rendono possibile il passaggio di ioni non si ottenne per una membrana biologica, ma per membrane lipidiche artificiali, in cui era stato introdotto un antibiotico, la gramicidina A. Questa sostanza, estratta da Bacillus brevis, è anch'essa una sostanza di ‛offesa', utilizzata dal batterio per eliminare i concorrenti nel suo spazio vitale, mettendo in ‛cortocircuito' le loro membrane cellulari.
Le informazioni a tutt'oggi disponibili sulla struttura chimica e sul comportamento dei pori di membrane biologiche sono di gran lunga inferiori rispetto a quelle riguardanti i pori aperti nelle membrane lipidiche artificiali. Pertanto, sebbene i pori delle membrane cellulari non possano essere completamente identificati - per struttura e funzione - con quelli aperti dalla gramicidina, tenteremo di spiegarne le caratteristiche proprietà con l'esempio che segue, riguardante appunto la gramicidina.
La gramicidina A è un polipeptide lineare costituito da 15 amminoacidi neutri, che si avvolge in una struttura elicoidale (almeno nella fase lipidica) stabilizzata da ponti a idrogeno (v. fig. 20). La risultante struttura, a forma di tubo lungo circa 1,2-1,5 nm, possiede all'interno un canale, del diametro di circa 0,4 nm, le cui pareti sono costituite essenzialmente da gruppi >C=O e che è aperto alle due estremità. All'esterno del canale sono disposte le catene idrofobe. Se si aggiunge una quantità estremamente piccola di gramicidina alle due fasi esterne da una parte e dall'altra di una doppia membrana lipidica, le singole molecole di gramicidina penetrano nella membrana e formano dimeri che si agganciano testa a testa e attraversano la fase lipidica come piccoli canali ripieni di elettroliti. Se si misura la conducibilità, si osserva che insorgono improvvisamente piccoli aumenti di conducibilità di entità costante, che poi scompaiono di nuovo (v. fig. 21) e che riflettono chiaramente il processo, insorto casualmente, di formazione e di scomposizione dei dimeri e quindi il processo di costruzione dei pori. La conducibilità dei singoli canali dipende, sotto forma di una cinetica di saturazione, dalla concentrazione elettrolitica della soluzione esterna. Ad esempio, il suo valore a temperatura ambiente, in soluzione di NaCl 0,1 M, è di 6 pS. Da questo dato si calcola un trasferimento di circa 4 milioni di ioni al secondo per ogni dimero di gramicidina, con una differenza di potenziale applicata di 100 mv. Questo trasferimento è superiore di vari ordini di grandezza a quei trasferimenti che si ottenevano mediante un carrier diffusibile o mediante la variazione conformazionale delle proteine di membrana.
Per chiarire meglio il problema della diffusione via poro e via carrier si può aggiungere che la gramicidina è inefficace negli strati lipidici spessi, i quali non permettono più alcuna associazione dimerica, mentre l'efficacia della valinomicina, diffusibile, non subisce in questo caso alcuna perdita. Se si raffredda la membrana, in modo che i lipidi assumano uno stato di aggregazione solido, la conducibilità indotta dalla gramicidina rimane pressoché costante, mentre la conducibilità indotta dalla valinomicina scende di circa 4 ordini di grandezza (immobilizzazione del carrier diffusibile). Si ricordi anche che i pori di gramicidina sono in pratica permeabili ai cationi monovalenti, ma non agli anioni. Il rapporto PK+/PNa+ è di 3,5. Oltre alla gramicidina A si conoscono altre sostanze in grado di formare pori (v. tab. V).
Oltre alla dimostrazione della conducibilità quasi del tutto quantizzata (dei singoli canali), esistono altre caratteristiche del trasporto attraverso pori che si possono ugualmente spiegare tramite l'esempio della gramicidina: ad es. la fluttuazione di corrente e la diffusione in singola fila.
Fluttuazione di corrente (v. Verveen e De Felice, 1974). In presenza di concentrazioni relativamente alte di gramicidina A si formano numerosi canali singoli i cui tempi di apertura si sovrappongono parzialmente, così che la conducibilità complessiva della membrana subisce forti oscillazioni temporali. Se poi si impone alla membrana una differenza di potenziale costante, le oscillazioni si traducono in flussi di corrente. Analizzando l'oscillazione della corrente si può calcolare, in condizioni semplificate, la conducibilità del singolo canale e la vita media dei canali. Condizione per la fluttuazione di corrente è ovviamente che i canali non rimangano costantemente aperti, ma che si aprano e si chiudano spontaneamente.
Diffusione in singola fila. La diffusione in singola fila fu osservata per la prima volta da Hodgkin e Keynes (v., 1955) nello studio sulla misura di flussi di traccianti di potassio negli assoni giganti di calamaro e fu più tardi elaborata teoricamente da Heckmann (v. Heckmann e Vollmerhaus, 1970). Essa consiste in uno speciale fenomeno di interazione del flusso di tracciante, che avviene attraverso pori lunghi e stretti, per cui le singole particelle non possono scambiare il loro posto all'interno del poro; per trasportare ogni particella attraverso la membrana è necessario che siano sospinte contemporaneamente tutte le particelle che occupano il poro, ciascuna nella sua posizione, in fila con le altre. Se si misura la permeabilità del tracciante (P*i) quando il flusso netto è zero (Ji=0), si trovano valori molto minori di quelli che si otterrebbero misurando la permeabilità (Pi) in presenza di flussi netti. Ciò significa, in base all'equazione (13), che abbiamo forti coefficienti positivi di accoppiamento di flusso (L*0≫0). In confronto al poro a un posto solo (che non presenta alcuna diffusione in singola fila) il flusso di una particella marcata attraverso un lungo poro del tipo a ‛singola fila', a più posti, viene ostacolato dalla presenza, nei posti vicini, di particelle non marcate. Questo spiega la bassa permeabilità del tracciante. D'altra parte quando Ji≠0, le particelle marcate vengono trascinate dalle particelle non marcate e questo effetto è tanto più forte quanto più lungo è il poro. Ne consegue la ben nota discrepanza tra il rapporto di flussi unidirezionali di tracciante e il rapporto dei potenziali chimici nelle fasi esterne, che si riconcilia in una funzione esponenziale del numero dei siti presenti nei pori.
I pori formati dalla gramicidina A presentano la diffusione in singola fila con due siti. Si ricordi che anche i pori a singola fila presentano una tipica cinetica di saturazione, se si misura la dipendenza del flusso netto Ji dalla concentrazione åi. I flussi unidirezionali mostrano tuttavia una dipendenza sigmoidale dalla concentrazione, per cui il campo delle basse concentrazioni viene descritto nuovamente tramite una funzione esponenziale del numero dei siti del poro.
Sembra che pori elettricamente conduttori aventi caratteristiche simili ai pori di gramicidina A esistano in quasi tutte le membrane cellulari e siano responsabili soprattutto dei flussi cationici passivi. Questo è quanto si verifica per i canali del K+ nelle cellule nervose e muscolari, come è dimostrato dall'osservazione della diffusione in singola fila, dall'analisi delle variazioni della conducibilità e dall'osservazione diretta dei singoli canali e della misura della loro conduttività (‛pori che si aprono e chiudono spontaneamente'). Anche nella placca motrice del muscolo è stata dimostrata l'esistenza di pori elettricamente conduttori, che prendono parte alla trasmissione dell'eccitamento dai nervi al muscolo (v. sinapsi: Fisiologia della sinapsi periferica). Essi si aprono non appena l'acetilcolina riversata dalle vescicole presinaptiche nello spazio sinaptico si lega alla membrana postsinaptica e si richiudono allorché il mediatore si stacca dalla membrana (pori controllati chimicamente). Questi canali sono permeabili agli ioni Na+, K+ e Cl-. Una registrazione originale dell'attività di simili singoli canali si può trovare nella fig. 22. Dall'analisi del ‛rumore' risulta, inoltre, che la conducibilità per il calcio, caratteristica della membrana cellulare del muscolo cardiaco e di alcune cellule gangliari giganti di Gasteropodi, è dovuta a pori elettricamente conduttori. In seguito verranno descritti canali ionici specifici per l'Na+, presenti sulla superficie della pelle di rana e sulla superficie mucosale della vescica urinaria.
Un caso particolare è quello dei canali dell'Na+ e del Ca2+ delle membrane eccitabili, i quali si aprono in dipendenza dalla differenza di potenziale di membrana e si richiudono dopo breve tempo spontaneamente (‛pori controllati dal potenziale elettrico'). Si immagina che all'interno di questi canali esista una ‛porta' che mantiene chiusi i pori quando il potenziale di membrana è ‛a riposo'. Se il potenziale di membrana cade al di sotto di un valore soglia, si apre la ‛porta' che permette il passaggio della corrente di ioni sodio. Il tempo di apertura è però di breve durata, perchè il poro viene di nuovo chiuso da una seconda variazione conformazionale, probabilmente indipendente; la ‛porta' ritorna allora alla sua posizione di partenza. Lo spostamento di carica all'apertura della porta viene direttamente registrato come ‛corrente di apertura' (gating current). Questi pori controllati dal potenziale permettono alle cellule nervose e muscolari di invertire in breve tempo il potenziale di membrana (potenziale d'azione). Sono quindi responsabili dell'eccitamento e della sua conduzione nelle cellule nervose e provocano la contrazione delle cellule muscolari (v. elettrofisiologia; neurone e impulso nervoso; sinapsi). Si ricordi, inoltre, che finora non è stata chiarita la costituzione molecolare di tutte le strutture dei pori, nonostante gli intensi sforzi dei biochimici. Inoltre, non si conoscono finora pori selettivi per gli anioni, liberamente permeabili.
β) Pori non conduttori (pori a scambio ionico). Si consideri come esempio il sistema di trasporto degli anioni nella membrana eritrocitaria, tramite il quale avviene lo scambio di bicarbonato (HCO−3) contro cloruro (Cl-). Mentre il sangue scorre attraverso il tessuto, il CO2 diffonde nei globuli rossi e forma, in presenza di anidrasi carbonica, HCO−3. Una parte del bicarbonato viene temporaneamente trasportata verso l'esterno, nel plasma sanguigno, in scambio con Cl-; l'HCO−3 viene però poi riassorbito dai globuli rossi durante il passaggio del sangue attraverso il polmone (in scambio con Cl-), quindi ritrasformato in CO2 ed espirato come gas (v. sangue: Emoglobina; regolazione dell'equilibrio acido-base; respirazione, regolazione chimica della). Il sistema di trasporto non scambia solo HCO−−3 contro Cl-, ma anche Cl- contro Cl-. Per questo motivo non lo aggiungiamo a quei sistemi di accoppiamento di flusso per sostanze diverse, che tratteremo separatamente nel successivo È b.
Se si rende la membrana eritrocitaria molto permeabile ai cationi tramite l'aggiunta di valinomicina e K+, e si misura poi il flusso netto di Cl-, si trova una permeabilità al Cl- relativamente bassa, cioè PCl=2,8×10-8 cm/s. Se però si ripete la misura dell'equilibrio per il Cl- (cioè JCl-=0), si trova una permeabilità del tracciante del Cl- più di 10.000 volte maggiore, cioè P*CL-=5×10-4 cm/s. Dall'equazione (13) si ottiene che la membrana possiede un coefficiente di accoppiamento per il tracciante estremamente negativo (L*0〈0): dunque, sebbene la membrana eritrocitaria sia, in confronto a quella di altre cellule, relativamente poco permeabile per i flussi netti degli ioni cloro, vengono scambiati continuamente, con un rapporto 1 : 1 e molto velocemente, ioni cloro di un lato della membrana con ioni cloro dell'altro lato. Si parla, quindi, anche di ‛diffusione per scambio'. Da una misura più accurata del sistema si trova che, quando si hanno flussi passivi all'equilibrio, lo scambio dipende solo dall'agitazione termica delle molecole e che l'andamento del flusso presenta più o meno tutte quelle caratteristiche che abbiamo trovato anche per il modello del carrier. Possiamo tuttavia escludere il modello del carrier diffusibile, dato che sappiamo che il trasporto viene indotto da una proteina di membrana fissa (v. fig. 7), che si estende sei volte da una parte all'altra della membrana formando delle anse. Nella gel-elettroforesi della membrana eritrocitaria la proteina, che ha un peso molecolare di 96.000, si sposta con la cosiddetta banda III.
Sebbene non se ne conosca ancora la sequenza amminoacidica e la struttura molecolare, si può attualmente ipotizzare che la proteina formi, tra i singoli bracci che attraversano la membrana, una specie di poro, chiuso tuttavia da una ‛porta' (pori non conduttori). Questa ‛porta', probabilmente un residuo di lisina alla cui carica positiva si può legare un Cl-, può essere presente o dal lato cis o da quello trans della membrana. Il ribaltamento viene ostacolato però dalla barriera energetica (carica positiva sulla parete opposta del poro?) e avviene solo quando la carica viene neutralizzata dal legame con un anione. Dalle differenti costanti di legame per diversi inibitori del trasporto si può concludere che il ribaltamento della ‛porta' è legato alle variazioni conformazionali della struttura proteica che avvengono nelle vicinanze; tali variazioni impediscono probabilmente lo slittamento di un secondo Cl- (v. fig. 23). Un simile modello dovrebbe realizzare uno scambio 1 : 1 Cl-/Cl-, dato che la ‛porta' può ribaltarsi sul lato opposto solo se viene caricata su un lato da Cl-. D'altra parte si sa, in base agli studi sull'inibizione e sull'energia di attivazione, che la maggior parte dei flussi netti di ioni cloro passa ugualmente attraverso le proteine della banda III. Si ammette perciò che un Cl- possa occasionalmente scivolare attraverso il poro, senza legarsi e senza provocare la variazione conformazionale. Meccanismi di scambio simili a quello Cl-/HCO−3 o Cl-/Cl- sembrano verificarsi anche in diverse cellule epiteliali e forse in cellule muscolari.
b) Trasporto tramite accoppiamento del flusso di sostanze diverse.
Nel paragrafo precedente abbiamo parlato dei trasporti di sostanze i dovuti alla differenza di potenziale elettrochimico fra le sostanze stesse. Abbiamo visto che anche in questo tipo di trasporto è possibile osservare dei fenomeni di accoppiamento del flusso, e cioè essenzialmente accoppiamenti tra il flusso del componente chimico i e quello di un isotopo i*. Abbiamo notato inoltre l'insorgenza di accoppiamenti tra sostanze diverse, se queste presentano una struttura molecolare simile (come per es. D-xilosio e D-glucosio nel trasporto degli zuccheri, Cl- e HCO−3 nel sistema di trasporto anionico degli eritrociti oppure anche K+ e Rb+ nel flusso contemporaneo attraverso un poro a singola fila, che non abbiamo però descritto dettagliatamente). Questi accoppiamenti avvengono perché il rispettivo sito di legame o di riconoscimento della proteina di trasporto non è completamente selettivo per un solo componente, ma può legare o lasciar passare (con diversa affinità) anche altri componenti aventi struttura o dimensioni simili. Dobbiamo quindi aspettarci un comportamento analogo a quello dell'accoppiamento del tracciante, che in effetti è stato realmente osservato. Esistono però, specialmente nelle membrane biologiche, accoppiamenti di flusso tra particelle del tutto diverse dal punto di vista strutturale, come per esempio tra NaCl e acqua o H+ e amminoacidi. Prenderemo quindi in considerazione accoppiamenti di questo tipo tra diversi tipi di sostanze i e j (j≠i). Si può trovare eccezionalmente che un flusso misurabile di i (Ji≠0) presupponga la presenza del componente j e che Lii=Lij=Ljj; ne consegue che i flussi Ji e Jj sono ugualmente grandi. Parliamo in questo caso di cotrasporto (simporto) o, nel caso in cui i flussi abbiano segni opposti, di controtrasporto (antiporto).
1. Accoppiamento tra acqua e soluti. - Secondo l'equazione (16) il coefficiente di accoppiamento Liw=Lwi viene spesso caratterizzato dal coefficiente di riflessione σi. Esistono misure sistematiche di coefficienti di riflessione di diversi non elettroliti per membrane cellulari di piante, di eritrociti e per cellule epiteliali della cistifellea. Per la cistifellea si trovano valori attorno allo zero per sostanze come il cloroformio, il butanolo, la piridina, che sono liposolubili, e per le sostanze 2-6 della fig. 12. Le sostanze con liposolubilità molto bassa, come zuccheri e amminoacidi, e le sostanze 56 e 57 della fig. 12 hanno valori di σ attorno a 1,0.
Per i coefficienti di riflessione valgono quindi le stesse regole dei coefficienti di permeabilità, vale a dire più alto è il valore della liposolubilità, maggiore sarà la permeabilità e minore il coefficiente di riflessione. Esistono poche misure precise dei coefficienti di riflessione della membrana cellulare per singoli ioni. In generale, si può ammettere che i coefficienti di riflessione per gli ioni dei metalli alcalini e per gli alogenuri siano vicini a 1. Le membrane epiteliali, nelle quali il trasporto di materia non avviene soltanto attraverso le cellule ma anche attraverso gli spazi intercellulari (via paracellulare), presentano dei valori nettamente inferiori (tubulo prossimale del rene). Sono stati descritti valori di σi=0,6 per Na+ e Cl-.
2. Accoppiamento tra diversi soluti. - Nella diffusione libera in soluzioni diluite, i coefficienti crociati (Lij), che descrivono il flusso di un componente i libero in dipendenza dalla forza motrice di un altro componente j, sono di solito piccoli in confronto al coefficiente diretto (Lii oppure Ljj). I dati riportati nella tab. VI riguardano soluzioni di cloruro di sodio. Ne consegue che nelle soluzioni libere i fenomeni di accoppiamento tra i flussi di singoli ioni o tra ioni e non elettroliti assumono importanza minima. Ciò però non è valido per i flussi attraverso membrane. Infatti, allorché la libertà di movimento delle particelle viene limitata dalla membrana (come per esempio all'interno di un lungo poro), l'importanza dei coefficienti crociati aumenta in proporzione a quella dei coefficienti diretti.
In caso estremo, quando il poro è molto lungo e così stretto che le particelle non riescono a passarsi davanti l'una all'altra, si ha il caso della diffusione in singola fila, che è stato trattato in precedenza, per il quale i coefficienti crociati Lij possono assumere valori fortemente positivi. Nella pelle di rana si sono osservati, per l'urea e il glucosio, quei fenomeni di accoppiamento di flusso che si possono verificare attraverso pori ripieni d'acqua.
Tuttavia oltre ai fenomeni di accoppiamento di flusso, relativamente aspecifici, che si verificano attraverso lunghi pori non selettivi, esistono anche, in numerose membrane biologiche, accoppiamenti di flusso altamente selettivi, che sono dovuti a speciali proteine di trasporto. Come esempio possiamo prendere in considerazione il trasporto accoppiato di sodio e glucosio, esistente a livello della parete cellulare luminale (orletto a spazzola) dell'intestino tenue e del rene, e osservato in numerosi esperimenti su epiteli integri (misure di flusso, misure elettriche) e su vescicole di membrana isolate. Nell'epitelio integro si è trovato che il flusso di glucosio dipende dalla concentrazione di glucosio e dalla concentrazione di sodio nel lume, rispettivamente, delle anse intestinali e dei tubuli renali, e che questa dipendenza può essere descritta da una semplice cinetica di saturazione (equazione 36) con valori di Km di 1 mmol/l per il glucosio e di 15 mmol/l per il sodio (queste cifre valgono per il tubulo prossimale del rene di ratto).
Lo studio effettuato sulle vescicole di membrane con orletto a spazzola ha messo in evidenza le seguenti caratteristiche.
I. In assenza di ioni sodio, lo zucchero può diffondere lungo un gradiente di concentrazione all'interno delle vescicole; le velocità di trasporto sono però molto piccole e portano sempre solo a un equilibrio di concentrazione tra la fase interna e quella esterna (v. flg. 24, curva a). Questo trasporto non è specifico (il D- e l'L-glucosio hanno più o meno la stessa velocità) e non può essere inibito dalla florizina.
II. In presenza di ioni sodio (cN′%a+=cN′′a+), il trasporto di D-glucosio (ma non quello di L-glucosio) viene accelerato (v. fig. 24, curva b), vale a dire che la concentrazione del glucosio nelle vescicole aumenta ora più velocemente fino a eguagliare la concentrazione della fase esterna. La florizina può abolire l'aumento di flusso. La presenza di una sostanza j (Na+), anziché rallentare il flusso, come nel caso della competizione di galattosio e glucosio per lo stesso sito di legame (vedi il modello di carrier semplice), in questo caso accelera il flusso di i (glucosio).
III. Se si crea un gradiente di Na+ aggiungendo NaCl alla fase esterna, ma non all'ambiente vescicolare, si accelera l'assorbimento di glucosio così fortemente che la concentrazione di glucosio nelle vescicole supera temporaneamente la concentrazione nella fase esterna (v. fig. 24, curva c trasporto contro gradiente di concentrazione). Quando l'afflusso di Na+ finisce, il glucosio diffonde di nuovo all'esterno, finché si raggiunge l'equilibrio di concentrazione tra la fase interna e quella esterna. Questo effetto è specifico per gli ioni sodio e il D-glucosio (non si osserva nel caso di ioni potassio o della colina né per l'L-glucosio) e viene inibito dalla florizina.
IV. L'afflusso di glucosio in presenza del gradiente di concentrazione di Na+ viene ulteriormente accelerato quando si impone un potenziale di membrana di polarità adeguata (fase interna delle vescicole negativa), sostituendo lo ione cloruro con lo ione tiocianato, solubile nei lipidi (v. fig. 24, curva d). Il flusso di glucosio viene stimolato non solo dalla differenza di concentrazione dell'Na+, ma anche dalla differenza di potenziale elettrico.
V. Un gradiente di concentrazione di D-glucosio non marcato tra la fase interna e quella esterna accelera l'assorbimento del D-glucosio marcato (controtrasporto), ma solo in presenza di ioni sodio.
VI. Il trasporto è altamente selettivo per il D-glucosio; gli altri zuccheri vengono difficilmente trasportati, oppure non lo sono affatto (v. fig. 25).
In accordo con i risultati ottenuti su vescicole della membrana della parete cellulare luminale del rene o dell'epitelio intestinale, le misure elettrofisiologiche dirette su cellule renali integre hanno rivelato che la presenza di glucosio porta un improvviso aumento della conducibilità parziale della parete cellulare luminale per gli ioni sodio.
Si può pertanto concludere che esiste un meccanismo di accoppiamento di flusso per Na+ e D-glucosio nella parete cellulare luminale delle cellule epiteliali che permette una traslocazione solo quando sono legati sul trasportatore sia l'Na+ sia il D-glucosio; siamo cioè in presenza di un cotrasporto obbligato. Determinazioni quantitative suggeriscono un rapporto stechiometrico di 1 : 1. Si tenga presente che si tratta di un meccanismo di trasporto puramente passivo, che avviene senza rifornimento di energia da parte di una reazione chimica e porta sempre solo all'equilibrio di concentrazione. È possibile avere un trasporto ‛in salita' di zucchero solo quando esiste contemporaneamente come forza motrice un gradiente di Na+ ‛in discesa' oppure una corrispondente differenza di potenziale elettrico. Non è stato ancora spiegato il meccanismo molecolare del cotrasporto di Na+ e glucosio.
Tutti i tentativi finora compiuti per giungere a una descrizione matematica del modello portano a un carrier diffusibile che possiede due siti di legame, uno per l'Na+ e uno per il glucosio, e che può attraversare la membrana solo quando i siti sono ambedue caricati. Se confrontiamo questo meccanismo con altri sistemi di trasporto e ne analizziamo le analogie, dobbiamo concludere che la rappresentazione di un carrier diffusibile non è esatta e che anche in questo caso dovremmo essere in presenza di un meccanismo fondato su pori che provoca una variazione conformazionale qualsiasi del trasportatore, quando ambedue i siti di legame sono occupati. Si sono osservati fenomeni di accoppiamento di flusso che presentano simili proprietà in numerose membrane (v. tab. VII). Esistono, oltre ai coefficienti positivi Lij (cotrasporto o simporto; per es. accoppiamento del flusso di sodio e glucosio), anche sistemi con coefficienti negativi, Lij〈0 (controtrasporto o antiporto). Un tipico esempio si riscontra nel sistema di trasporto di ATP e ADP della membrana mitocondriale, che trasporta ATP verso l'esterno scambiandolo con ADP in direzione opposta.
Come già discusso e spiegato (v. cap. 4, È c), intendiamo per trasporto attivo il trasporto di una componente i in assenza di tutte le differenze di potenziale elettrochimico (cioè di tutte le forze passive) mediante accoppiamento con una reazione chimica. Dobbiamo distinguere, nelle membrane composte, fra trasporto attivo primario e secondario. Mentre il trasporto attivo primario si realizza, in una membrana asimmetrica, attraverso un accoppiamento locale con una reazione chimica, il trasporto attivo secondario è causato da un accoppiamento di flusso passivo con una componente trasportata mediante trasporto attivo primario.
Parleremo prima del trasporto attivo primario, iniziando col trasporto attivo di Na+/K+ nella membrana cellulare. Poiché tale sistema è stato riconosciuto come il principale sistema di trasporto attivo, la sua descrizione è strettamente legata ai tentativi fatti per definire questo tipo di trasporto. Il trasporto attivo di H+ nella membrana mitocondriale e nella membrana fotosintetica è filogeneticamente più vecchio ed è collegato in serie, nel ciclo di energia della cellula, al trasporto di Na+/K+.
1. Trasporto attivo primario. - Trasporto di Na+/K+. Probabilmente tutte le cellule dei Vertebrati e di molti Invertebrati e almeno alcune cellule vegetali (Alghe) presentano nella membrana cellulare un meccanismo di trasporto attivo primario, che pompa fuori dalla cellula Na+ e trasporta all'interno della cellula K+. L'energia per questo trasporto deriva dalla scissione dell'ATP.
Gli studi relativi alla scoperta e alla caratterizzazione di questa pompa Na+/K+ sono durati decine di anni e ancora oggi non si è giunti a una spiegazione conclusiva di tale meccanismo di trasporto. In un primo tempo si osservò che la distribuzione ionica tra lo spazio extracellulare e quello intracellulare di cellule viventi non è in equilibrio elettrochimico. Come è riportato nella tab. VIII, la deviazione è più evidente per Na+ e Ca2+ e meno per K+. Sebbene la parete cellulare sia permeabile a questi ioni (come si può facilmente dimostrare mediante esperimenti con traccianti) e sebbene Na+ e Ca2+ siano continuamente spinti dentro la cellula da un gradiente di potenziale elettrochimico mentre K+ viene spinto fuori dalla cellula, i gradienti di concentrazione perdurano stabili finché il metabolismo è funzionante. Se però si blocca il metabolismo mediante raffreddamento o veleni, Na+, Ca2⊥ Cl- e acqua diffondono all'interno delle cellule, K+ all'esterno, e la differenza di potenziale elettrico a cavallo della parete cellulare si riduce moltissimo. Le cellule si trovano quindi normalmente in una situazione che si definisce di stop flow oppure di static head: i flussi netti di tutte le sostanze permeabili (eccetto di quelle che entrano a far parte del metabolismo, cioè O2, glucosio e CO2) sono uguali a zero; malgrado ciò, per alcuni componenti permeabili esiste tra le cellule e l'interstizio una differenza di potenziale elettrochimico. La spiegazione, dedotta facilmente dall'equazione (18), sta nella presenza di un trasporto attivo di uno o più componenti permeabili (per es. Na+ e/o K+). Un progresso decisivo portarono, nel 1951, gli esperimenti di Ussing sulla pelle di rana, i cui risultati riassumiamo brevemente (v. Ussing e Zerahn, 1951): a) dopo eliminazione di tutte le differenze di pressione, concentrazione e potenziale tra il lato esterno e il lato del sangue, la pelle di rana trasporta continuamente Na+ dall'esterno verso il lato del sangue, mentre non si verificano flussi netti misurabili di K+ o Cl- (in seguito si trovò una piccola secrezione di H+, e in alcuni tipi di rana un trasporto netto di Cl-); b) nelle stesse condizioni la pelle produce una corrente elettrica (corrente di cortocircuito) che è identica quantitativamente al trasporto netto di Na+ (cioè, alla differenza tra il flusso di 22Na+ dal lato esterno al lato del sangue e il flusso di 24Na+ misurato contemporaneamente dal lato del sangue verso l'esterno); c) il trasporto netto di sodio e la corrente di cortocircuito sono aboliti quando il metabolismo viene bloccato; d) tra il trasporto di Na+ e il consumo di ossigeno del tessuto esiste una relazione stechiometrica di circa 20 moli Na+/mole O2; e) il trasporto è legato alla presenza di ioni potassio dal lato della pelle rivolto verso il sangue; in presenza di soluzioni prive di potassio il trasporto scompare lentamente per poi risalire di nuovo al valore di partenza con il ripristino di concentrazioni fisiologiche di potassio (questa osservazione rende probabile una combinazione del trasporto transepiteliale di sodio con la pompa Na+/K+ delle membrane cellulari).
Questi esperimenti dimostravano chiaramente, per la prima volta, l'esistenza del trasporto attivo di Na+ e inoltre suggerivano come probabile il fatto che si trattasse di un trasporto attivo primario. Data l'identità fra trasporto attivo di sodio e corrente di cortocircuito, si poteva escludere che si trattasse di un trasporto attivo secondario dovuto all'accoppiamento con altri flussi ionici sconosciuti.
L'analisi fu approfondita principalmente sull'assone gigante di calamaro e sugli eritrociti, la cui composizione ionica intracellulare può essere cambiata con opportune metodiche. Si è giunti cosi al seguente modello: a) le cellule trasportano attivamente sia gli ioni sodio, dall'interno all'esterno, sia gli ioni potassio, dall'esterno all'interno. Ambedue i trasporti sono strettamente accoppiati. Se si sottraggono ioni potassio dalla soluzione esterna, l'efflusso attivo di ioni sodio si ferma e, ugualmente, se l'interno della cellula fosse privato di ioni Na+, l'afflusso attivo di ioni K+ sarebbe bloccato. Nella membrana eritrocitaria il rapporto di accoppiamento è di 3 ioni sodio in scambio con 2 ioni potassio. La pompa Na+/K+ perciò dà origine a una corrente elettrica (pompa parzialmente elettrogenica). Il meccanismo di trasporto è altamente selettivo per Na+ (nessuno dei restanti metalli alcalini può sostituire Na+) ma poco selettivo per K+. Il potassio può essere sostituito con decrescente efficacia da rubidio, ammonio, cesio e litio; b) l'energia per il trasporto proviene dalla scissione idrolitica dell'ATP (adenosintrifosfato) in ADP (adenosindifosfato) e in fosfato inorganico:
ATP+H2O→ADP+Pi;
l'ATP viene prodotto nei mitocondri come veicolo di energia della cellula. Tramite la scissione di una molecola di ATP vengono trasportati 3 Na+ all'esterno e 2 K+ all'interno (v. fig. 26); c) il trasporto attivo di Na+/K+ viene inibito in modo altamente specifico dai glucosidi della digitale, per esempio la strofantina G (ouabaina); l'ouabaina agisce solo se viene somministrata alla cellula dal lato esterno,ove compete con il K+ per il sito di legame. Il legame della ouabaina si forma rapidamente ed è reversibile; la velocità di dissociazione del complesso è però diversa da animale ad animale e da organo a organo. In casi favorevoli (eritrociti dell'uomo) si possono marcare i siti di trasporto nella membrana con ouabaina-3H, per poterli poi contare: queste misure portano a una stima di circa 200 siti di trasporto per globulo rosso; d) il processo dì trasporto attivo e invertibile: se si fanno incubare eritrociti impoveriti di ATP con una soluzione esterna ricca di Na+ e priva di K+, si ottiene un afflusso di Na+ accoppiato a un efflusso di K+ che può essere inibito dalla ouabaina, cioè gli ioni Na+ e K+ passano attraverso la pompa in direzione opposta. Questo processo porta alla sintesi di ATP. Ogni due o tre ioni K+ trasportati viene formata una molecola di ATP da ADP e fosfato inorganico marcato radioattivamente. Se si introduce ouabaina, cessa anche la sintesi di ATP.
Per poter studiare più in dettaglio il sistema di trasporto è importante isolarlo e ricostruirlo completamente, senza, in pratica, perdita di attività da parte delle membrane cellulari. Dalla elettroforesi su gel si ottengono due proteine con pesi molecolari di 100.000 e 50.000: tutte le caratteristiche del trasporto sono da attribuire alla proteina più grande. Il sistema di trasporto agisce biochimicamente come ATP-asi (enzima che scinde l'ATP), la cui attività viene regolata dalla concentrazione di Na+, K+ e Mg2+ (v. fig. 27). L'enzima viene inibito, analogamente al trasporto, dalla ouabaina e l'inibizione presenta, in molti casi, la stessa dipendenza dalla concentrazione dell'inibizione del trasporto di Na+/K+ nella membrana originaria. Si trova, inoltre, in diversi tessuti, una correlazione significativa tra l'attività ATP-asica e l'entità del trasporto attivo di sodio. Il risultato biochimico più interessante è la dimostrazione dell'esistenza di un prodotto di fosforilazione che si costituisce per trasferimento del fosfato ricco di energia dall'ATP all'enzima, in presenza di Na+ e Mg2+, e che si scinde subito in presenza di K+. Nella fig. 28 si trova lo schema della relazione ottenuta studiando i diversi effetti stimolanti e inibenti la fosforilazione. In base a questo schema si ammette che l'enzima possa esistere in due diverse conformazioni: nella forma defosforilata E′ i siti di legame del sodio sono scoperti dalla parte citoplasmatica della membrana; non appena si sono legati gli ioni sodio, l'enzima puo' essere fosforilato dall'ATP in presenza di Mg2+. La fosforilazione provoca un cambiamento conformazionale e porta allo stato E″; gli ioni Na+ legati vengono così trasferiti dal lato interno della membrana verso il lato esterno. Nella forma E″, i siti di legame perdono la loro selettività verso gli ioni sodio e legano preferibilmente gli ioni potassio. Gli ioni sodio diffondono perciò nella fase esterna. Non appena gli ioni K+ della fase esterna si legano all'enzima, ha luogo la defosforilazione e l'enzima ritorna allo stato E′. Questa variazione conformazionale è legata al trasporto degli ioni K+ dalla fase esterna alla fase interna, dove gli ioni K+ si dissociano nuovamente, perché i siti di legame nello stato E′ sono più affini agli ioni Na+. Così il ciclo di trasporto può nuovamente iniziare.
Gli ultimi dubbi circa l'identità tra l'ATP-asi Na+/K+-dipendente e il sistema di trasporto Na+/K+ nella membrana cellulare furono dissipati quando si riuscì a introdurre l'enzima nei liposomi e a studiare il fenomeno del trasporto attivo di Na+/K+ in provetta.
Ulteriori sistemi di trasporto attivo con scissione dell'ATP. Citiamo al primo posto, accanto al trasporto di Na+/K+, il trasporto di Ca2+ esistente nel reticolo sarcoplasmatico della fibra muscolare. Questo sistema di trasporto, che nella fase di rilasciamento del muscolo assorbe ioni calcio dal citoplasma sequestrandoli in piccoli spazi vescicolari, è in grado di superare grosse differenze di concentrazione di calcio tra il citoplasma (10-7 mol/l) e lo spazio intravescicolare (da circa 10-3 fino a 10-2 mol/l). Il trasporto avviene grazie all'energia metabolica liberata in seguito alla scissione dell'ATP. Analogamente al trasporto di Na+/K+, anche in questo caso esiste una relazione stechiometrica fissa: per ogni molecola di ATP vengono assorbite 2 molecole di Ca2+. È indispensabile la presenza di Mg2+. I tentativi di isolare l'enzima hanno portato a risultati analoghi a quelli relativi al trasporto di Na+/K+. L'enzima agisce biochimicamente come una ATP-asi, che viene stimolata da Ca2+ e Mg2+. L'ATP-asi Ca2+/Mg2+-dipendente funziona, come l'ATP-asi Na+/K+-dipendente, solo in presenza di lipidi. L'ATP-asi Ca2+-dipendente non è caratteristica del reticolo sarcoplasmatico del muscolo, ma ne sono state descritte altre in diverse membrane cellulari, quali quelle dello stomaco, dell'intestino e del rene; sono state altresì identificate ATP-asi che vengono attivate da HCO−3 o da K+ e che sono probabilmente connesse al trasporto attivo primario di ioni idrogeno in questi organi. Nonostante le numerose osservazioni sull'esistenza di un trasporto attivo di cloruro (pelle di rana, sostanza midollare del rene, cellule nervose) non è stata finora dimostrata l'esistenza in cellule animali di un'ATP-asi stimolata da Cl-. Il trasporto di Cl- è da classificare molto probabilmente nel gruppo dei trasporti attivi secondari. Tuttavia, un'ATP-asi stimolata da Cl- è stata ritrovata in cellule vegetali.
Trasporto attivo di H+ nelle membrane mitocondriali. I mitocondri rappresentano il luogo in cui avviene la respirazione cellulare. In essi, attraverso una serie di sistemi redox (catena respiratoria), l'idrogeno dei carboidrati demoliti nel metabolismo viene ‛bruciato' in presenza dell'ossigeno assunto con la respirazione a formare acqua, e l'energia che si libera con la formazione d'acqua viene fissata nella sintesi di un legame chimico ricco di energia (ATP da ADP e fosfato). Le reazioni redox sono legate al trasporto attivo di ioni idrogeno dall'interno dei mitocondri alla fase esterna. Si crea così, a cavallo della membrana mitocondriale, una differenza di potenziale elettrochimico per gli H+, che induce la sintesi di ATP (v. Mitchell, 1966).
Se a una sospensione di mitocondri isolati, e mantenuti in assenza di ossigeno (anaerobiosi), si aggiunge una piccola quantità di ossigeno (che viene consumata in circa 1 s), si osserva che il valore del pH nella fase esterna cade improvvisamente (ugualmente in circa 1 s) e poi ritorna lentamente al valore di partenza con andamento esponenziale (v. fig. 29). Un'approfondita analisi di questa osservazione e ulteriori studi portarono alle seguenti conclusioni: a) l'acidificazione iniziale della fase esterna viene provocata dal trasporto di H+ dallo spazio della matrice mitocondriale verso l'esterno. L'acidificazione non avviene se si perturba la fase lipidica della membrana con detergenti (es.: Triton X-100); b) la quota di trasporto di H+ è in rapporto stechiometrico fisso con l'ossigeno consumato. Se si aggiunge una piccola quantità di ossigeno, il flusso di ritorno di H+, durante il tempo in cui gli H+ diffondono, diventa trascurabile, così che si può calcolare la quantità di ioni H+ trasportati per atomo di ossigeno consumato dal massimo spostamento del pH e dalla capacità tampone della sospensione dei mitocondri. Questi calcoli portano a rapporti costanti JH+/IO2 di 6 in presenza di acido β-idrossibutirrico come substrato e di 4 in presenza di succinato, che interviene nella respirazione a un diverso livello; c) il rapporto stechiometrico è indipendente dalla composizione ionica del mezzo e non viene alterato né dagli ionofori (per es. valinomicina) né da disaccoppianti o da inibitori specifici dell'ATP-asi (oligomicina), bensì da veleni della catena respiratoria. Così il rotenone abbassa i quoziente JH+/IO2, da 6 a 2 in presenza dell'acido β-idrossibutirrico, il cianuro blocca tutto; d) il trasporto degli ioni H+ verso l'esterno genera un potenziale di membrana (fase esterna positiva, fase interna negativa). Dato che la differenza di potenziale non può venire misurata direttamente, in quanto i mitocondri sono troppo piccoli per essere penetrati con i microelettrodi, si sono utilizzati metodi indiretti (misura della distribuzione di ioni liposolubili). I mitocondri, sede della respirazione cellulare, concentrano nel loro interno cationi liposolubili, per es. il TPMP+ (trifenilmetilfosfonio) e riducono la concentrazione di anioni liposolubili, per es. il TPB(tetrafenilborato), nello stesso rapporto, in base alla concentrazione della fase esterna. Dato che questi ioni possono permeare liberamente attraverso le membrane lipidiche, la loro distribuzione opposta può essere provocata, allo stato stazionario, solo da un potenziale di membrana (ambiente interno negativo); e) se si misura contemporaneamente la differenza di pH e la differenza di potenziale, in condizioni di respirazione stazionaria, si ottiene una differenza di potenziale elettrochimico per gli ioni idrogeno (ΔηH+) pari a 22.000 J/mol. Questa corrisponde a una differenza di potenziale EH+, che si potrebbe teoricamente misurare con un paio di elettrodi a H+ (la cosiddetta ‛forza motrice protonica'):
dove l'ambiente interno (qui definito fase ′) è negativo. I valori della differenza di potenziale elettrico variano notevolmente (tra circa - 70 e - 160 mV, ambiente interno negativo). Questi risultati indicano che l'acidificazione della fase esterna dei mitocondri respiranti è causata dal trasporto attivo, verso l'esterno, di ioni idrogeno, che è accoppiato alla catena respiratoria ed è alimentato energeticamente dall'ossidazione del substrato donatore di idrogeno. Secondo l'ipotesi di Mitchell (v. fig. 30) i sistemi redox della membrana mitocondriale devono essere disposti in tre anse a S, in cui gli elettroni corrono da un sistema all'altro in cascata e in misura corrispondente al gradiente del potenziale redox; la disposizione spaziale dei sistemi nella membrana causa il passaggio ininterrotto degli elettroni da un lato all'altro della membrana. Dopo ogni passaggio di due elettroni dalla fase esterna alla fase interna, due ioni H+ devono essere trasportati dall'interno all'esterno insieme con due elettroni.
Il ritorno esponenziale del pH, così spostato, al valore di partenza, nella fig. 29, indica il flusso di ritorno passivo di H+ verso l'interno, lungo altre vie. Questa conclusi one può essere dedotta da ciò che segue: a) l'andamento nel tempo corrisponde esattamente alla scomparsa di un abbassamento improvviso di pH nella fase esterna provocato dall'aggiunta improvvisa di acidi; b) se si aumenta la permeabilità della membrana all'H+ tramite aggiunta di un disaccoppiante (carrier di ioni idrogeno come DNP, 2,4-dinitrofenolo, o FCCP, carbonilcianuro p-trifluorometossifenilidrazone), l'abbassamento del pH si dissipa più rapidamente (v. curva b nella fig. 29); c) la fase della scomparsa può essere decisamente accelerata dalla presenza di singoli cationi o anioni; in questo caso una parte degli ioni H+ viene assorbita all'interno e accelerata da sistemi di cotrasporto o controtrasporto (accoppiamento di flusso con fosfato o Na+).
Per concludere questo argomento, si deve ancora ricordare che il gradiente di ioni H+ rappresenta l'elemento di accoppiamento tra la catena respiratoria e la formazione di ATP e che la formazione di ATP da ADP e fosfato avviene grazie a una ATP-asi, presente nella membrana mitocondriale, divisa spazialmente dalla catena respiratoria e stimolata direttamente dal gradiente degli ioni idrogeno. Il meccanismo della formazione di ATP sembra quindi essere analogo al meccanismo ‛invertito' della pompa Na+/K+, con la differenza che l'energia non viene fornita dal gradiente di Na+/K+, bensì dal gradiente di H+. Se si aggiunge un carrier per l'H+, come DNP o FCCP, in modo da impedire la formazione di gradiente, il consumo di ossigeno e il trasporto di H+ sono massimali, ma non si ha più alcuna sintesi di ATP (queste sostanze agiscono quindi come ‛disaccoppianti').
Trasporto attivo di H+ nella membrana fotosintetica. Il processo principale della fotosintesi è l'assorbimento di fotoni. L'energia assorbita viene trasmessa sotto forma di stati elettronici eccitati a una reazione fotochimica che provoca una separazione di carica. Come conseguenza si ottengono processi di trasferimento di elettroni dai sistemi redox e si forma acqua. A seconda della disposizione direzionale dei sistemi redox nella membrana il trasferimento di elettroni porta, analogamente a quanto avviene nella membrana mitocondriale, al trasporto direzionato di H+ e alla formazione di una differenza di potenziale elettrochimico per gli ioni H+ sulla membrana tilacoide.
Trasporto attivo di H+ nella membrana purpurea (pompa H+ a induzione luminosa). Al contrario di quanto avviene nella membrana fotosintetica, il trasporto attivo di ioni H+ attraverso la membrana purpurea non è legato ai sistemi redox. La membrana purpurea è uno strato proteico quasi omogeneo, che si costituisce sotto forma di singole macchie nella membrana cellulare dei batteri del sale (Halobacterium halobium) quando questi vengono esposti, dopo un lungo tempo in carenza di ossigeno, a un afflusso di luce sufficiente. Essa è costituita per il 25% da lipidi e per il 75% da un'unica proteina, la rodopsina batterica. Il nome di membrana purpurea deriva dal colore intensamente violetto della proteina, che si può isolare facilmente, e il nome di rodopsina batterica è dovuto al fatto che la proteina possiede lo stesso cromoforo (il retinale) presente anche nel pigmento visivo degli animali (rodopsina). Quando la rodopsina batterica è adattata alla luce, il retinale è nella forma ‛tutto-trans' ed è legato a una catena laterale di lisina sotto forma di una base di Schiff. Il massimo d'assorbimento della semplice base di Schiff del retinale è alla lunghezza d'onda di 370 nm, quello dell'opsina batterica (dopo allontanamento del retinale) è a 280 nm e quello della rodopsina batterica è a 560 nm. Questo spostamento dell'assorbimento è indice di una stretta interazione tra il retinale e l'opsina. Se si colpisce con radiazioni luminose la rodopsina batterica, questa passa attraverso una serie di variazioni conformazionali di diversa durata, che hanno differenti massimi di assorbimento, e poi ritorna al suo stato fondamentale. In questo processo solo il primo stadio della reazione dipende dalla luce. Questo ciclo fotochimico avviene in pochi ms ed è legato all'emissione di un protone dalla membrana verso la fase esterna e all'assorbimento di un protone dal citoplasma nella membrana. Il flusso protonico dipendente dalla luce è stato dimostrato in cellule batteriche intatte e in liposomi in cui è stata inserita la rodopsina batterica. Il flusso protonico, avente le caratteristiche di un trasporto attivo, instaura una differenza di potenziale elettrochimico per l'H+ tra l'interno della cellula e la fase esterna e crea così il presupposto per la sintesi di ATP, analogamente a quanto avviene nei mitocondri e nelle membrane tilacoidi. Sebbene siano ormai state studiate le sequenze degli amminoacidi e la struttura secondaria della proteina, non si è riusciti ancora a spiegare il meccanismo di trasporto degli ioni H+. La proteina è costituita da 240 amminoacidi, ha un peso molecolare di 26.000 e forma un'elica che si avvolge in tutto 7 volte da una parte all'altra della membrana (v. fig. 31). Il sito di legame del retinale è vicino al centro della membrana nella posizione 41 (lisina). La rodopsina batterica e senz altro la più semplice proteina conosciuta in grado di produrre un trasporto attivo.
2. Trasporto attivo secondario. - Come si è spiegato (v. cap. 4, È c), alcuni sistemi di membrane possono trasportare attivamente, secondo la definizione dell'equazione (19), una sostanza i, sebbene nessuna delle singole membrane mostri di per sé un trasporto attivo di i. Tale fenomeno è spiegabile se si ammette che il flusso di i in una membrana del sistema sia accoppiato al flusso di un'altra sostanza j, trasportata attivamente in un'altra membrana del sistema. Questa situazione si riscontra negli epiteli. Consideriamo come esempio l'assorbimento attivo di zucchero nel rene e nell'intestino. Come si vede nella fig. 32, la membrana cellulare controluminale (che è rivolta verso il lato del sangue) presenta sia una pompa attiva per l'Na+ (indicata con A nella fig. 32), che trasporta ioni Na+ dall'interno della cellula verso il lato del sangue, sia un meccanismo di trasporto passivo per il glucosio (indicato con C), mentre la membrana cellulare luminale presenta un meccanismo di cotrasporto Na+-glucosio (indicato con B). La pompa del sodio è una pompa di scambio sodio-potassio che può essere inibita dalla ouabaina, è parzialmente elettrogenica e viene mossa dall'ATP (v. sopra, punto 1); il meccanismo di trasporto del glucosio della membrana cellulare controluminale può essere inibito dalla floretina e corrisponde al meccanismo di trasporto di zucchero degli eritrociti, descritto nel È a, 2; il meccanismo di cotrasporto sodio-glucosio della membrana cellulare luminale può essere inibito dalla florizina ma non dalla floretina ed è stato descritto dettagliatamente in precedenza.
La cooperazione tra questi tre meccanismi di trasporto ha il seguente effetto. La pompa del sodio abbassa la concentrazione del sodio intracellulare a circa 10-15 mmol/l (in confronto, la concentrazione di sodio del liquido extracellulare luminale e controluminale è di circa 144 mmol/l) e crea un potenziale di membrana di circa −80 mV, citoplasma-negativo (questa differenza di potenziale esiste su entrambe le membrane cellulari, dato che il potenziale riscontrato nei liquidi luminale e controluminale è approssimativamente lo stesso). Gli ioni Na+ possono quindi entrare nella cellula dal lume del tubulo renale (o dall'ansa intestinale) secondo il gradiente di potenziale elettrochimico, a condizione che ci siano abbastanza molecole di glucosio. Il risultato è che la concentrazione intracellulare di glucosio aumenta e le molecole di glucosio possono infine diffondere secondo il loro gradiente di concentrazione, grazie al meccanismo di trasporto, nella membrana controluminale verso il lato del sangue.
L'effetto totale di questo sistema è che il glucosio viene trasportato continuamente dal lume verso il lato del sangue anche nel caso in cui i liquidi abbiano una composizione assolutamente identica da ambedue i lati della cellula. Si tratta quindi di un trasporto attivo transepiteliale di glucosio che viene mantenuto soltanto dal contemporaneo trasporto attivo di sodio (trasporto attivo secondario). Se si riduce il trasporto di sodio (per es. bloccando la pompa con l'onabaina) diminuisce anche il trasporto di glucosio; oppure, al contrario, se si abbassa la concentrazione di glucosio, cala anche il trasporto attivo di sodio. L'esistenza di uno stretto accoppiamento del trasporto di Na+ e glucosio spiega il fatto che l'aggiunta di glucosio, un non elettrolita, alla soluzione esterna instaura una differenza di potenziale e una corrente di cortocircuito transepiteliale (espressione del trasporto di ioni sodio).
Il trasporto attivo secondario è molto rappresentato in tutte le formazioni cellulari epiteliali. Nel rene, il meccanismo di trasporto è responsabile dell'assorbimento di bicarbonato (secrezione di ioni H+), così come dell'assorbimento di glucosio, amminoacidi, acidi mono- e dicarbossilici, acidi biliari, fosfato, solfato e calcio (v. fig. 33); simile situazione si ritrova nell'intestino.
Bisogna considerare come trasporto attivo secondario anche il cosiddetto trasporto d'acqua isotonico. Per quanto riguarda il trasporto d'acqua, gli epiteli si devono dividere in due grossi gruppi: un gruppo (vescica urinaria, tubulo distale e dotto collettore del rene) presenta un flusso d'acqua transepiteliale misurabile solo quando esiste un gradiente osmotico, l'altro (intestino tenue, cistifellea e tubulo prossimale del rene) è in grado di trasportare acqua quando non esiste alcun gradiente osmotico. Se si perfondono gli epiteli del secondo gruppo con la stessa soluzione (Ringer NaCl) dal lato luminale e dal lato del sangue e si mantiene in funzione il metabolismo, si osserva che NaCl e acqua vengono trasportati dal lume al lato del sangue e che il liquido trasportato presenta, nei limiti di misure precise, una concentrazione osmotica uguale alla soluzione esterna (trasporto isotonico dell'acqua). Secondo la definizione dell'equazione (19) si tratta di un trasporto attivo di acqua. Il trasporto d'acqua si ferma, però, se si blocca il trasporto attivo di sodio con l'ouabaina, la qual cosa ci porta alla conclusione che il trasporto di acqua è un trasporto attivo secondario, accoppiato con il trasporto attivo di sodio.
Contrariamente al trasporto di zucchero, il trasporto attivo secondario dell'acqua non può però avvenire mediante meccanismi tipo quelli via pori o mediati da carrier, in quanto per ogni ione sodio vengono trasportate circa 370 molecole d'acqua. Probabilmente si tratta di un accoppiamento di flusso mediante osmosi locale (v. fig. 34). In base a questo modello si suppone che il trasporto attivo di sale crei in particolari regioni dell'epitelio (per es. negli spazi laterali tra le cellule epiteliali; v. anche cap. 1) delle zone a concentrazione osmotica più elevata nelle quali l'acqua può fluire dal lume dell'intestino o del tubulo renale. Aumenta perciò la pressione idrostatica e il liquido viene sospinto nell'interstizio. L'equilibrio osmotico del liquido trasportato con la soluzione nelle fasi esterne si attua solo nell'ultimo tratto di percorso del trasporto.
d) Trasporto tramite vescicole.
Tutti i meccanismi di trasporto descritti nei capitoli precedenti riguardano sostanze di piccolo peso molecolare. Per il trasporto di proteine e di altre sostanze ad alto peso molecolare (a partire da 1.000-4.000) la natura ha sviluppato speciali meccanismi di trasporto. Queste sostanze vengono rinchiuse in una invaginazione della membrana cellulare, visibile al microscopio ottico o elettronico, che poi si svuota all'interno della cellula (endocitosi); oppure delle vescicole preformate entrano in contatto con la parete cellulare e svuotano il loro contenuto all'esterno (esocitosi). In questo modo proteine o particelle più grandi (per es. frammenti cellulari) o batteri vengono assorbiti nella cellula per la digestione, mentre ormoni o enzimi prodotti dentro la cellula vengono espulsi dalla cellula nell'ambiente circostante. In tutti e due i casi si tratta di reazioni estremamente complicate, di cui la causa e il decorso non sono stati ancora analizzati a fondo.
Il primo passo dell'endocitosi nel rene sembra essere il legame delle macromolecole a siti specifici localizzati sulla superficie della membrana. Il legame provoca poi una neoformazione locale di materiali di membrana, che si distingue chiaramente dal resto della parete cellulare, per lo meno nel rene, per la composizione lipidica e proteica. il ripiegamento all'interno sembra avvenire, come per una striscia bimetallica, a causa delle diverse forze di superficie di ambedue le lamelle lipidiche della membrana cellulare neoformata. Dopo l'assorbimento nelle cellule, le vescicole endocitotiche si fondono insieme e formano i lisosomi nei quali si verifica la digestione delle proteine. L'esocitosi è stata analizzata soprattutto nelle placche neuromuscolari (liberazione di acetilcolina) e nelle cellule ghiandolari (secrezione di enzimi digestivi o di ormoni). In tutti e due i casi gli ormoni specifici e gli enzimi vengono formati nel reticolo endoplasmatico della cellula e vengono accumulati in vescicole, completamente circondate da una membrana lipidica. Se si stimola la cellula elettricamente o chimicamente, le vescicole si legano alla membrana cellulare in siti ben definiti, si fondono con essa, si aprono e liberano il contenuto all'esterno (v. fig. 35). Questo processo viene avviato da un incremento della concentrazione intracellulare di Ca2+; la membrana delle vescicole poi o viene riassorbita nella membrana cellulare circostante, oppure, riseparata, torna nella cellula come un piccolo vacuolo.
(L'autore ringrazia la prof.ssa S. Curci, dell'Istituto di Fisiologia Generale dell'Università di Bari, e il prof. D. Cremaschi, dell'Istituto di Fisiologia Generale dell'Università Statale di Milano, per il prezioso contributo dato alla traduzione italiana di questo articolo).
Bibliografia.
Danielli, J. F., Davson, H., A contribution to the theory of permeation of thin films, in ‟Journal of cellular and comparative physiology", 1935, V, pp. 495-508.
Frömter, E., Stofftransport durch biologische Membranen, in Biophysik - ein Lehrbuch (a cura di W. Hoppe, W. Lohmann, H. Markl e H. Ziegler), Heidelberg 1977, pp. 328-361.
Goldman, D. E., Potential, impedance and rectification in membranes, in ‟Journal of general physiology", 1943, XXVII, pp. 37-60.
Gorter, E., Grendel, F., On bimolecular layers of lipoids on the chromocytes of the blood, in ‟Journal of experimental medicine", 1925, XLI, pp. 439-443.
Heckmann, K., Vollmerhaus, W., Zur Theorie der ‛single-file' Diffusion, in ‟Zeitschrift für physikalische Chemie", 1970, LXXI, pp. 320-328.
Hodgkin, A. L., Katz, B., The effect of sodium ions on the electrical activity of the giant axon of the squid, in ‟Journal of physiology", 1949, CVIII, pp. 37-77.
Hodgkin, A. L., Keynes, R. D., The potassium permeability of a giant nerve fibre, in ‟Journal of physiology", 1955, CXXVIII, pp. 61-88.
Katchalsky, A., Curran, P. F., Non-equilibrium thermodynamics in biophysics, Cambridge, Mass., 1967.
Kedem, O., Katchalsky, A., Thermodynamic analysis of the permeability of biological membranes to non-electrolytes, in ‟Biochimica et biophysica acta", 1958, XXVII, pp. 229-246.
Meyer, K. H., Sievers, J. F., La permèabilité des membranes. I. Théorie de la perméabilité ionique, in ‟Helvetica chimica acta", 1936, XIX, pp. 649-664.
Mitchell, P., Chemiosmotic coupling in oxidative and photosynthetic phosphorylation, in ‟Biological reviews", 1966, XLI, pp. 445-502.
Onsager, L., Reciprocal relations in irreversible processes, in ‟Physical reviews", 1931, XXXVII, pp. 405-426.
Osterhout, W. J. V., How do electrolytes enter the cell?, in ‟Proceedings of the National Academy of Sciences", 1935, XXI, pp. 125-132.
Renkin, E. M., Pappenheimer, J. R., Wasserdurchlässigkeit und Permeabilität der Kapillarwände, in ‟Ergebnisse der Physiologie", 1957, XLIX, pp. 59-126.
Sauer, F., Non-equilibrium thermodynamics of kidney tubule transport, in Handbook of physiology, sect. 8, Renal physiology (a cura di R. W. Berliner e J. Orloff), Washington 1973, pp. 399-414.
Schlögl, R., Stofftransport durch Membranen, Darmstadt 1964.
Stavermann, A. J., Non-equilibrium thermodynamics of membrane processes, in ‟Transactions of the Faraday Society", 1952, XLVIII, p. 176.
Stein, W. D., The movement of molecules across cell membranes, New York 1967.
Teorell, T., An attempt to formulate a quantitative theory of membrane permeability, in ‟Proceedings of the Society for Experimental Biology and Medicine", 1935, XXXIII, pp. 282-285.
Ussing, H. H., Zerahn, K., Active transport of sodium as the source of electric current in the short circuited isolated frog skin epithelium, in ‟Acta physiologica scandinavica", 1951, XXIII, pp. 110-127.
Verveen, A. A., De Felice, L. J., Membrane noise, in ‟Progress in biophysics and molecular biology", 1974, XXVIII, pp. 189-265.
Wilbrandt, W., Rosenberg, T., The concept of carrier transport and its corollaries in pharmacology, in ‟Pharmacological reviews", 1961, XIII, pp. 109-183.
© Istituto della Enciclopedia Italiana - Riproduzione riservata