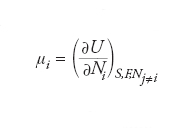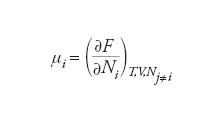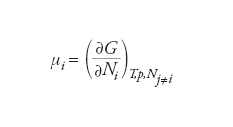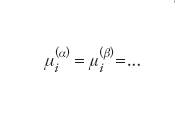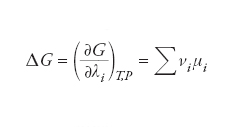Potenziale chimico
Enciclopedia della Scienza e della Tecnica (2008)
potenziale chimico
Grandezza termodinamica intensiva generalmente indicata con μ introdotta per la prima volta nella seconda metà dell’Ottocento da Josiah Willard Gibbs, e definito per ciascun componente i presente in una miscela. Il potenziale chimico di una qualsiasi sostanza, in un sistema termodinamico, è uguale alla variazione di energia interna che il sistema subisce se viene aggiunta una piccola quantità della medesima sostanza, a entropia e volume costanti, divisa per la massa della sostanza aggiunta. In termini formali se si considera un sistema con energia interna U, entropia S, volume V e contenente Ni moli di diversi componenti, il potenziale chimico del componente i è espresso da:
ma esso può essere anche espresso in funzione dell’energia libera di Helmholtz F=U−TS, attraverso la relazione:
Tali definizioni sono fra loro equivalenti e la scelta sul loro impiego è di carattere puramente strumentale, ovvero connessa con le caratteristiche del problema che si deve affrontare. In generale si preferisce utilizzare l’ultima equazione poiché la funzione G può essere agevolmente valutata dalle informazioni sul comportamento di stato di una miscela. Il potenziale chimico così determinato dipende dalla temperatura, dalla pressione e dalla composizione del sistema stesso. Il potenziale chimico viene impiegato per esprimere le condizioni di equilibrio in un sistema a più fasi e più componenti. Infatti se α, β,..., sono le fasi presenti nel sistema, a temperatura e pressione costanti le condizioni di equilibrio si esprimono come segue:
che, nell’insieme, costituisce un sistema di equazioni algebriche la cui soluzione fornisce la composizione di ciascuna delle fasi in equilibrio. Inoltre, la variazione di energia libera di una reazione chimica reversibile, condotta a temperatura e pressione costanti, può essere espressa dai potenziali chimici dei diversi componenti come segue:
dove λ è il grado di avanzamento della reazione e νi i loro coefficienti stechiometrici. In condizioni di equilibrio tale variazione di energia libera deve essere nulla, per cui, ricordando che il potenziale chimico dipende dalla composizione dalla relazione precedente, è possibile individuare la composizione di equilibrio del sistema stesso.
© Istituto della Enciclopedia Italiana - Riproduzione riservata