NGF (sigla dell'ingl Nerve Growth Factor)
Dizionario di Medicina (2010)
NGF (sigla dell’ingl. Nerve Growth Factor)
La storia della scoperta dell’NGF può essere riassunta in poche, grandi tappe: per primi sono stati identificati ormoni e vitamine, poi sono venuti i neurotrasmettitori o mediatori chimici che svolgono il loro ruolo nell’ambito del sistema nervoso, infine sono stati identificati, dagli anni Cinquanta del secolo scorso, i fattori di crescita, di cui l’NGF rappresenta il capostipite. La sua scoperta, dovuta a Rita Levi Montalcini, seguita da quella dell’EGF da parte di Stanley Cohen, ha portato alla luce un’intera nuova classe di messaggeri extracellulari e ha costituito un punto di partenza, perché l’NGF rappresenta il capostipite di una importante classe di messaggeri, le neurotrofine, costituita da altri fattori quali il BDNF, l’NT3 e l’NT4. La scoperta dell’NGF ha suggerito che esistono proteine analoghe ma dotate di azione su altre popolazioni nervose che non rispondono all’NGF e sono collettivamente denominate neurotrofine, poiché esplicano un ruolo fondamentale per la sopravvivenza delle loro cellule bersaglio. A partire dei primi anni del secolo è emerso che questa funzione trofica o vitale non sempre si esplica in modo per così dire ‘attivo’ ma, al contrario, consiste in un’azione inibitoria, nel tenere cioè sotto controllo un programma di morte presente nel DNA di ogni cellula: se questo programma viene attivato, perché viene a mancare il segnale inibitorio, numerosi geni e le corrispettive proteine intracellulari vengono attivati e in breve la cellula va incontro a morte per apoptosi, un evento che potrebbe anche essere alla base dell’insorgenza di malattie neurodegenerative. Studi condotti sull’NGF hanno dimostrato, infatti, che l’apoptosi si accompagna causalmente con la produzione di peptidi altamente tossici responsabili del morbo di Alzheimer. Altre indagini hanno inoltre messo sempre più in evidenza il ruolo ‘organismico’ dell’NGF, con la dimostrazione di un suo coinvolgimento non solo nel sistema nervoso centrale e periferico ma anche nel sistema endocrino e in quello che presiede alla difesa dell’organismo. [➔ Alzheimer, malattia di; apoptosi; cervello, sviluppo del; neurodegenerazione; neurotrofine; recettore nervoso]
L’NGF è una proteina che svolge un’azione trofica, tropica e differenziativa su cellule nervose o collegate funzionalmente al sistema nervoso, come le cellule endocrine e immunitarie.
Background scientifico della scoperta
Negli anni Quaranta del secolo scorso un problema a lungo dibattuto fra gli embriologi era centrato sul ruolo del territorio periferico sull’entità dell’innervazione dello stesso territorio. Poiché si osservava una stretta correlazione fra questi due parametri, due erano le ipotesi funzionali al riguardo. Una, sostenuta fra gli altri da Viktor Hamburger, attribuiva al territorio stesso da innervare un ruolo attivo. Secondo questa ipotesi le fibre nervose in crescita ed espansione ‘sentivano’ la dimensione e si comportavano di conseguenza. A dimostrazione di questa conclusione si adduceva un esperimento effettuato da Elmer Bueker nel quale anche un territorio amorfo come quello costituito da un tumore induceva una abnorme crescita di fibre nervose. Secondo un’altra ipotesi, portata avanti da Levi-Montalcini, il territorio periferico o il tumore impiantato nell’embrione rilasciava un fattore diffusibile che induceva la crescita delle fibre nervose. La ripetizione degli esperimenti di Bueker rivelò un fatto nuovo e stupefacente: gangli simpatici a notevole distanza dal tumore e nell’impossibilità di stabilire contatto con il tessuto neoplastico andavano incontro a uno straordinario aumento in volume, simile a quello dei gangli che innervavano il tumore stesso. Le fibre soprannumerarie prodotte dai gangli simpatici invadevano in modo caotico e anomalo gli organi che, in condizioni normali, a questo stadio dello sviluppo embrionale non erano ancora innervati e non stabilivano rapporti sinaptici con le cellule degli organi, infrangendo il principio basilare che stabilisce di norma un contatto diretto tra fibre nervose e cellule innervate. Questo effetto era una prova irrefutabile che le cellule neoplastiche rilasciavano un fattore umorale (che venne denominato nerve growth promoting activity e successivamente nerve growth factor) in grado di alterare i normali processi differenziativi delle cellule nervose simpatiche recettive alla sua azione. L’identificazione di questo fattore umorale era resa estremamente complessa dalla difficoltà e dalla lunghezza degli esperimenti che avevano portato alla luce l’esistenza di questo fattore umorale. Si trattava di mettere a punto un sistema più semplice e rapido per l’identificazione del fattore.
L’effetto alone
Frammenti dei tumori sarcoma 37 e 180 – già impiegati per gli studi in vivo sull’embrione di pollo, previo il loro innesto negli stessi embrioni – vennero trapiantati in mezzi di coltura semisolidi in prossimità di gangli sensitivi e simpatici di embrioni di otto giorni. Dalle cellule di questi gangli, coltivate per 24 ore in vitro, in prossimità, ma non a diretto contatto, dei tumori, si formava un fittissimo alone di fibre nervose a forma di raggiera. Inoltre, nei gangli coltivati per un periodo più lungo, le fibre dal lato prospiciente il frammento di tumore non soltanto erano molto più dense che dal lato opposto, ma si orientavano verso il tessuto neoplastico indicando non solo l’azione di promozione della crescita delle fibre nervose ma anche un’azione tropica, ossia di indirizzo della crescita verso la sorgente del fattore. Nel 1953, la collaborazione tra Rita Levi-Montalcini e il biochimico Stanley Cohen consentì la parziale identificazione chimica della frazione tumorale attiva. Nell’intento di chiarire se l’azione fosse dovuta alla componente proteica o nucleinica, Cohen espose la frazione nucleoproteica del sarcoma al veleno di serpente cobra, che conteneva alte concentrazioni di enzimi capaci di degradare gli acidi nucleici ma non le proteine. L’esame delle colture di gangli coltivati in un mezzo contenente l’estratto tumorale ad azione NGF, da solo o in presenza del veleno di serpente, svelò un effetto imprevedibile. L’alone di fibre nervose che irradiava dai gangli era centuplicato a paragone di quelli coltivati in presenza del solo fattore tumorale, mostrando così che il veleno era un’eccellente fonte di NGF. Cohen isolò parzialmente il fattore NGF da questa insperata e imprevedibile nuova sorgente. Studi successivi dimostrarono che le ghiandole di topo maschio adulto contenevano quantità di NGF ancora maggiori divenendo, ovviamente, la sorgente primaria di NGF per tutti i successivi studi. L’alta quantità di NGF estratto dalle ghiandole salivari murine rese possibile saggiare l’effetto non soltanto nell’embrione di pollo, ma in animali neonati e adulti. I roditori divennero l’oggetto favorito di questi esperimenti.
Attività neurotrofica e immunosimpaticectomia
L’iniezione sottocutanea di NGF purificato in topi per un periodo di 10 giorni provocava un aumento dei gangli simpatici delle catene para- e prevertebrali anche più imponente di quello che avveniva negli embrioni di pollo (effetto neurotrofico). Nel corso di questi studi Cohen osservò che queste iniezioni provocavano anche una maturazione precoce degli embrioni con eruzione dei denti e apertura della rima palpebrale. L’osservazione condusse all’identificazione di un secondo fattore che fu definito epidermal growth factor (EGF). NGF ed EGF si sarebbero in seguito rivelati i primi di un grande numero di fattori di natura proteica (IGF-1, IGF-2, la famiglie delle neurotrofine, TNF, ecc.) dotati di azioni specifiche su tutti gli organi e tessuti di un organismo. La dimostrazione di questi impressionanti effetti trofici e differenziativi esercitati dalla molecola NGF, tuttavia, era oggetto di un obiezione di fondo: come si poteva accettare che l’NGF fosse un fattore fisiologico quando era presente in massime quantità nei veleni dei serpenti o nelle ghiandole esocrine dei roditori? Sebbene la presenza di grandi quantità di NGF nei veleni non abbia ancora ricevuto una spiegazione convincente, un esperimento dimostrò nel 1959 in modo inequivocabile la natura fisiologica dell’NGF. L’esame istologico condotto in topolini in cui era stato iniettato siero contenente anticorpi diretti contro l’NGF dimostrò che i gangli simpatici erano ridotti a noduli sclerotici consistenti di cellule gliali e di un numero esiguo di cellule nervose in avanzato stato atrofico. Il fenomeno, reso noto nel 1960 con il termine immunosimpaticectomia, fu introdotto nella letteratura scientifica per designare l’effetto della distruzione delle cellule nervose simpatiche ottenuta con la somministrazione di un anticorpo specifico contro l’NGF. La rapidità del fenomeno e l’entità dei processi regressivi, che culminano nella morte delle cellule nervose, furono interpretate come prova irrefutabile della proprietà dell’NGF di esplicare un ruolo trofico (vitale) essenziale per la vita delle cellule stesse. Si è scoperto in seguito che l’azione trofica non consisteva in un effetto di tipo attivo, nutritizio, ma nel tenere bloccata l’apoptosi (➔), presente in tutte le cellule e che viene attivata non appena queste vengono deprivate di NGF circolante. Studi condotti nei successivi decenni con le tecniche di ingegneria genetica dimostrarono che topi omozigoti privati di NGF tramite manipolazioni genetiche muoiono poche settimane dopo la nascita. Topi eterozigoti, i quali esprimono concentrazioni di NGF o di altre neurotrofine ridotti a metà del normale, sono vitali ma mostrano un insieme considerevole e inaspettato di deficit come, nel caso dell’NGF, oltre a una riduzione marcata del sistema nervoso simpatico e in parte di quello sensoriale, una diminuzione dell’innervazione colinergica dell’ippocampo, una diminuita capacità di acquisizione e di ritenzione per tempi lunghi di eventi mnemonici.
Struttura dell’NGF
La molecola dell’NGF è costituita da due catene polipeptidiche: ciascuna ha peso molecolare di 13.250 kDa ed è formata da 118 amminoacidi. Ogni catena o monomero possiede tre ponti disolfuro tra residui dell’amminoacido cisteina che conferiscono una forte stabilità alla struttura tridimensionale della proteina. I due monomeri dell’NGF, uniti l’uno all’altro da legami deboli, formano un dimero di peso molecolare di 26.500 kDa. Le tecniche dell’ingegneria genetica permisero negli anni Ottanta di identificare il gene umano che codificava la molecola dell’NGF. Tale gene è localizzato nel braccio corto del cromosoma 1 e codifica la sintesi di una molecola molto più grande di quella di peso molecolare di 26.500 kDa che costituisce l’NGF circolante e biologicamente attivo. Il gene dell’NGF fornisce infatti le istruzioni per la sintesi di un precursore dell’NGF o pro-NGF di grandi dimensioni. È stato dimostrato che il gene dell’NGF è altamente conservato in specie differenti, dagli uccelli all’uomo.
NGF e recettori
Tutti i messaggeri extracellulari esercitano la loro azione tramite recettori presenti sulla superficie della cellula: l’azione dell’NGF dipende da due tipi di recettori denominati, rispettivamente, TrkA (Transmembrane tirosine kinase receptor) e p75. L’NGF, sintetizzato sotto forma di pro-NGF, viene in seguito scisso a formare un monomero di peso molecolare di 12 kDA. I monomeri si associano a formare dimeri dotati di attività biologica e di elevata affinità per il recettore TrkA. L’affinità per l’NGF di questo recettore richiede l’interazione con un secondo tipo di recettore, denominato p75, comune a tutte le neurotrofine. Alcuni studi hanno portato alla luce una proprietà peculiare di p75: questo recettore, infatti, può andare incontro ad attacco proteolitico da parte di proteasi che generano un peptide intracellulare il quale è capace, tramite interazioni con altri elementi intracellulari, di modulare l’espressione di numerosi geni. Tra questi geni di primaria importanza vi sono quelli che fanno parte del programma di morte per apoptosi. La morte cellulare programmata svolge un ruolo fondamentale nel corso dello sviluppo del cervello (➔) quando vengono eliminate per apoptosi le fibre nervose che, per motivi fisiologici, non hanno formato contatti sinaptici con le cellule bersaglio. È stato calcolato che ca. il 50% dei neuroni presenti alla nascita viene eliminato tramite questo processo di selezione sinaptica. È interessante notare, inoltre, che gli enzimi devoluti a processare p75 hanno proprietà assimilabili a beta- e gammasecretasi, due enzimi che generano il β-amiloide, un peptide altamente neurotossico ritenuto la causa primaria di malattie degenerative come il morbo di Alzheimer. Pertanto eventi apoptotici nel corso dello sviluppo svolgono un ruolo essenziale per la formazione appropriata dei circuiti, ma, se attivati nel cervello adulto, possono provocare la morte di cellule sane e causare malattie come il morbo di Alzheimer tramite la attivazione della produzione dei peptidi β-amiloidi.
Ruolo pleiotropico e organismico dell’NGF
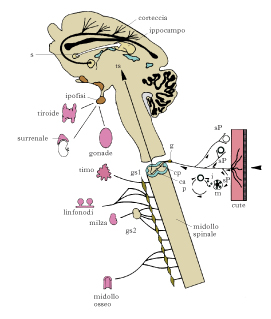
Per qualche decennio dopo la sua identificazione, l’azione dell’NGF era stata confinata al sistema nervoso periferico. Analoga limitazione ha riguardato l’EGF e altri fattori di crescita. Per questo motivo, si era stati indotti a collocare la funzione di questi fattori, che via via venivano scoperti, soltanto in relazione a tipi cellulari sui quali essi svolgevano la propria funzione specifica, attribuendo loro un ruolo subordinato rispetto, per es., alle vitamine o agli ormoni. In effetti, evidenze sperimentali hanno dimostrato che la sintesi dell’NGF è modulata da ormoni quale il testosterone: la sua quantità nella ghiandola salivare è 10 volte maggiore nei maschi murini e iniezioni di testosterone nelle femmine induce un aumento di NGF pari a quello maschile. Analogamente, è stato dimostrato che l’ormone tiroideo modula la sintesi di NGF nel cervello. Quindi, lo spettro d’azione dell’NGF e dell’EGF era ritenuto più ristretto nei tempi e nei modi rispetto alle due grandi categorie di messaggeri extracellulari, le vitamine e gli ormoni, scoperti molti decenni prima. Negli anni Ottanta, tuttavia, due tipi di osservazioni hanno elevato il ruolo di questi fattori alla classe di ormoni e vitamine e hanno accertato e accresciuto enormemente lo spettro di azioni e il ruolo funzionale. Si scoprì, infatti, che numerose varianti strutturali di geni che codificavano i recettori di numerosi fattori di crescita potevano provocare l’insorgenza di diversi tipi di tumori. Inoltre, l’estensione esponenziale degli studi sulle loro proprietà ha allargato le conoscenze sulle cellule dell’organismo che rispondono alla loro azione sia nel corso dello sviluppo sia nell’adulto. Questo impressionante allargamento di funzioni fisiologiche dell’NGF è venuto alla luce tramite due distinti approcci sperimentali: la somministrazione dell’NGF seguita dall’analisi dei suoi effetti per mezzo di tecniche più raffinate di quelle disponibili dopo la sua identificazione; il ricorso alle metodiche di neutralizzazione del gene che codifica l’NGF (tecnica di knock-out) seguite da un’analisi organismica delle mancate funzioni dell’NGF negli animali knock-out. L’insieme di questi studi ha dimostrato che l’NGF esercita talune funzioni di notevole rilievo nel controllo di funzioni ipotalamiche e ipofisarie.
Nuovi campi di indagine e di applicazioni dell’NGF
Il coinvolgimento dell’NGF in numerose patologie infiammatorie di varia natura, di intervento nelle risposte immunitarie e nell’instaurarsi della memoria immunologica ha aperto un intero campo di indagini e di possibili applicazioni cliniche. L’NGF sembra inoltre essere coinvolto, con funzioni ancora (2010) in parte da scoprire, nelle risposte di stress nel corso delle quali i livelli di questo fattore aumentano in modo consistente e sembrano svolgere un ruolo essenziale nelle funzioni surrenaliche. La sua applicazione per la cicatrizzazione delle ulcere da decubito e in altre patologie della pelle o nei fenomeni di iperalgesia allarga il suo ruolo anche alle superfici epiteliali.
NGF e patologie oculari. La scoperta di recettori ad alta affinità (TrkA) nelle cellule epiteliali della cornea ha suggerito la sperimentazione in vivo in modelli animali (conigli), seguita da prove sulla cornea di pazienti affetti da lesioni di differente natura. Di queste, la più frequente è quella provocata dall’infezione del tessuto corneale da Herpes simplex, seguita, per numero di casi, dalle lesioni provocate da infezioni batteriche, virali o conseguenti ad alterazioni traumatiche (lenti a contatto, oggetti, ecc.). L’NGF è stato somministrato per via topica (collirio) e in una larga parte dei pazienti trattati (a tutt’oggi – 2010 – una cinquantina) si è verificata una completa riparazione del tessuto corneale, che si evidenzia poche settimane dopo i primi trattamenti e perdura nei periodi successivi. L’effetto riparativo, studiato a livello istologico nel modello animale, ha dimostrato che questo è dovuto sia al fatto che le cellule corneali possiedono i recettori ad alta affinità per l’NGF e sono quindi in grado di captare e rispondere all’NGF, sia al fatto che l’NGF determina la reinnervazione del tessuto leso.
NGF e malattia di Alzheimer. La dimostrazione che l’azione dell’NGF consiste nel bloccare l’apoptosi ha suggerito che questa azione avesse un risvolto anche nelle patologie neurodegenerative, principalmente nell’insorgenza del morbo di Alzheimer. Studi condotti da Pietro Calissano e collaboratori nei laboratori del CNR hanno dimostrato che l’attivazione di eventi apoptotici, causati deprivando le colture di cellule nervose dei fattori neurotrofici fra i quali l’NGF, era seguita da un marcato aumento della produzione di peptidi amiloidi, derivati dal processamento anomalo della proteina di membrana APP (➔ Alzheimer, malattia di) e dalla loro aggregazione in strutture analoghe a quelle che nell’Alzheimer costituiscono le placche senili. Secondo l’ipotesi oggi più accreditata (ipotesi amiloidogenica), l’eccessiva produzione di questi peptidi, e in partic. di quello costituito da 42 amminoacidi (denominato Ab42), rappresenta l’evento scatenante e determinante nell’insorgenza di una progressiva serie di eventi intracellulari il cui esito finale è la degenerazione e la morte di intere popolazioni neuronali. L’approfondimento di questi studi ha inequivocabilmente dimostrato che la deprivazione di NGF provoca una serie di eventi molecolari del tutto sovrapponibili a quelli che si osservano in modelli animali di morbo di Alzheimer. Fra questi studi ricordiamo gli eleganti esperimenti condotti su topi adulti transgenici, nei quali l’espressione di anticorpi anti-NGF provoca la marcata riduzione di NGF cerebrale e si accompagna all’instaurarsi di una sindrome comportamentale e anatomopatologica analoga a quella che caratterizza l’Alzheimer. Nel loro insieme questi studi suggeriscono che fra le numerose e ancora in parte sconosciute cause dell’insorgenza di questa devastante malattia possa giocare un ruolo determinante la carenza di NGF nelle vie nervose che dipendono per la propria sopravvivenza dal normale e continuo rifornimento di questa neurotrofina. L’azione esercitata dall’NGF, un tempo definita semplicemente trofica e assimilata a una sorta di generica funzione nutritizia per la sopravvivenza delle cellule bersaglio, consiste in realtà nel blocco della produzione anomala o eccessiva dei peptidi neurotossici responsabili dell’inizio della malattia di Alzheimer.
Cinquant’anni di crescita dei fattori di crescita
I risultati conseguiti negli ultimi decenni hanno portato a enormi passi avanti nel cammino verso la comprensione dei meccanismi fisiopatologici preposti alla salute dell’uomo. A questi si è pervenuti integrando il metodo riduzionistico con quello olistico, che si avvale dello studio delle singole parti per ottenere una visione globale. Infatti, non si può contemplare un mosaico concentrando l’attenzione sulle singole tessere in quanto l’analisi più minuziosa delle parti non può fornire l’idea dell’insieme. Da questa filosofia di base nasce un diverso approccio sperimentale, volto a collegare, integrare, associare, così come sono collegati, integrati e associati i sistemi che operano per mantenere l’equilibrio dell’organismo. Gli attacchi sperimentali per la definitiva comprensione del meccanismo d’azione dell’NGF e delle concrete applicazioni terapeutiche di questa proteina potranno enormemente trarre vantaggio da questo approccio sperimentale globale. Pietro Calissano, Rita Levi-Montalcini