Glia
Dizionario di Medicina (2010)
glia
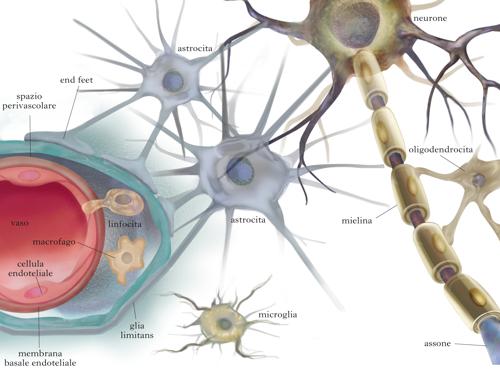
La glia, o neuroglia, è la maggiore componente cellulare del sistema nervoso, essendo da 10 a 50 volte più numerosa dei neuroni. Il nome venne introdotto a metà del 19° sec. per indicare la sostanza amorfa o ‘cemento nervoso’ che circondava e sosteneva i neuroni. Successivamente vennero riconosciute la natura cellulare della glia e l’esistenza di diversi tipi specializzati. Nel sistema nervoso dei vertebrati ne esistono due tipi, distinti per dimensioni e origine embrionale: la macroglia, di dimensioni maggiori e di origine neuro ectodermica, che include astrociti, oligodendrociti e cellule di Schwann, e la microglia, con cellule più piccole di origine mesodermica. Le cellule della glia, oltre a fornire sostegno ai neuroni, controllano l’ambiente interno del cervello, partecipano alla formazione di strutture specializzate come la barriera ematoencefalica e la guaina mielinica, assicurano l’isolamento delle cellule nervose e la loro protezione da agenti estranei o traumi. Il ruolo fondamentale della glia nello sviluppo e nel funzionamento del sistema nervoso è testimoniato dal loro coinvolgimento in molte importanti neuropatologie. [➔ demielinizzazione; differenziamento neuronale; mielina; neurodegenerazione; neurotrasmettitori; sinapsi] Le prime evidenze sperimentali a favore dell’esistenza di una ‘sostanza’ con funzione di tessuto connettivo nel sistema nervoso risalgono alla metà del 19° sec., quando indagini microscopiche portarono Rudolph Virchow a formulare l’ipotesi che le cellule nervose fossero circondate e sostenute da un ‘cemento nervoso’ (Nervenkitte), per il quale venne coniato il termine di glia (dal greco clèa, «colla»). Secondo la descrizione di Virchow, questa sostanza si presentava amorfa, molle, finemente granulare e al suo interno era presente un gran numero di elementi cellulari con grandi nuclei. Questi elementi vennero caratterizzati in seguito da altri studiosi, tra i quali Otto Dieters e Camillo Golgi, come elementi cellulari stellati, con prolungamenti filiformi che entrano in contatto talvolta con elementi cellulari ‘più propriamente’ nervosi, talvolta con altre cellule gliali o con i vasi sanguigni. Oggi, a più di centocinquanta anni dalla loro iniziale descrizione, conosciamo diversi tipi di cellule gliali, distinguibili per la morfologia e la dimensione del nucleo, per l‘origine embrionale e per le funzioni, molto più complesse dell’azione di supporto meccanico inizialmente proposto. Nel sistema nervoso dei vertebrati la g. viene classificata in macroglia, di origine neuroectodermica, e microglia, di origine mesodermica. La macroglia nel sistema nervoso centrale comprende astrociti, oligodendrociti e cellule ependimali. Queste ultime sono gli elementi cellulari che rivestono i ventricoli cerebrali e il canale centrale midollare, dove regolano la produzione, la circolazione e il riassorbimento del liquido cerebrospinale. Nel sistema nervoso periferico, la macroglia è rappresentata dalle cellule di Schwann, corrispettivi degli oligodendrociti del centrale e responsabili della formazione delle guaine mieliniche degli assoni periferici e dalle cellule satellite, che delimitano la superficie esterna dei neuroni nei gangli spinali.
Astrociti
Gli astrociti sono la componente gliale preponderante del sistema nervoso centrale e occupano dal 20 al 50% dell’intero volume cerebrale. Sono caratterizzati da un nucleo ovale, di ~10 µm di diametro, e da una morfologia stellata, a cui devono il nome. Gli astrociti sono classificati in protoplasmatici, distribuiti soprattutto nella sostanza grigia, e fibrosi, presenti sia nella sostanza grigia che nella sostanza bianca e così chiamati per la presenza di numerosi filamenti intermedi formati dalla proteina gliale fibrillare acida (GFAP, sigla dell’ingl. Glial Fibrillary Acidic Protein), caratteristica di queste cellule. Gli astrociti protoplasmatici sono meno ricchi di GFAP e i loro prolungamenti, simili a un velo, si insinuano tra gli spazi intercellulari per avvolgere il corpo cellulare di neuroni, assoni, dendriti e sinapsi. La distribuzione degli astrociti nel parenchima suggerisce l’esistenza di territori di competenza di ciascun astrocita. Dal centro di tali territori, l’astrocita estende i numerosi prolungamenti citoplasmatici, più o meno finemente arborizzati, per prendere contatto con altri elementi cellulari. Le estremità di alcuni di questi prolungamenti (pedicelli, o end feet), raggiungono la superficie del cervello e si estendono su di essa, formando un involucro (glia limitans) che isola e protegge l’intero cervello. Altri pedicelli vengono in contatto con i vasi cerebrali e, attraverso l’interazione con le cellule endoteliali dei vasi, contribuiscono alla formazione della barriera ematoencefalica, una struttura funzionale che regola l’ingresso selettivo di sostanze, per es. glucosio e altri nutrienti, dal sangue al parenchima cerebrale. Gli astrociti svolgono numerose funzioni, tutte volte al mantenimento delle condizioni per il funzionamento ottimale dei neuroni. Sono in grado, per es., di controllare il flusso ematico cerebrale; di favorire l’assorbimento di glucosio, la fonte principale di energia per i neuroni, e di immagazzinarlo sotto forma di glicogeno. Inoltre, gli astrociti che circondano le sinapsi rimuovono dallo spazio sinaptico alcuni neurotrasmettitori, quali il glutammato, attraverso trasportatori ad alta affinità. In questo modo, l’azione del neurotrasmettitore nello spazio extracellulare viene terminata, evitando gli effetti dannosi di una sovrastimolazione dei recettori postsinaptici (eccitotossicità). Grazie alla loro elevata permeabilità allo ione potassio (K+), gli astrociti garantiscono il mantenimento di concentrazioni fisiologiche di tale ione anche durante l’intensa attività di firing dei neuroni (ossia, la loro attività elettrica), prevenendone la depolarizzazione e l’ipereccitabilità. Infine, è stato ipotizzato che gli astrociti partecipino attivamente alla trasmissione sinaptica e agiscano come terzo elemento cellulare, che si aggiunge alla terminazione presinaptica e a quella postsinaptica. Questa ipotesi, riassunta nella definizione di sinapsi tripartita, si basa sulla capacità degli astrociti di rispondere all’attività sinaptica, grazie alla presenza sulla loro superficie di numerosi recettori per neurotrasmettitori, e di regolare a loro volta la trasmissione e la plasticità sinaptica.
Oligodendrociti
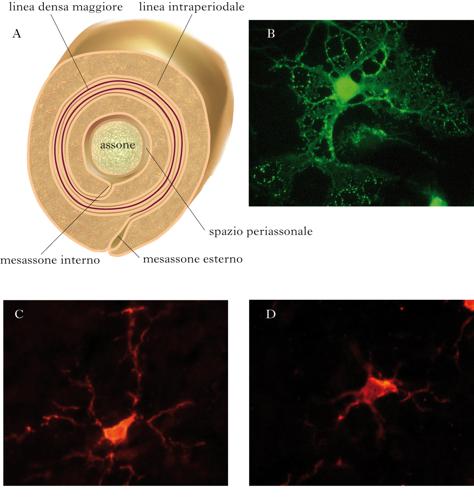
Rispetto agli astrociti, gli oligodendrociti sono cellule più piccole, con un nucleo rotondo di circa 8 µm di diametro, con pochi prolungamenti più fini e meglio definiti. In maniera analoga agli astrociti, sono stati descritti due tipi di oligodendrociti: quelli fascicolari, lungo le fibre nervose, dove i loro processi avvolgono gli assoni, formando la membrana mielinica, e quelli perineuronali o satellite, presenti nella sostanza grigia, in stretta associazione con il corpo cellulare dei neuroni. Gli oligodendrociti originano da precursori che derivano, a loro volta, dalle cellule neuroepiteliali del tubo neurale. Durante lo sviluppo i precursori degli oligodendrociti migrano per raggiungere la loro destinazione finale, dove in parte continuano a proliferare e in parte iniziano il processo di maturazione, sotto il controllo di molteplici segnali locali. Il processo di maturazione dei precursori inizia con la repressione dell’espressione di alcune proteine, come il recettore per il fattore di crescita (PDGFα, dall’ingl. Platelet Derived Growth Factor α) che costituisce un importante stimolo per la proliferazione dei precursori, e l’attivazione di geni per le proteine tipiche della mielina. In seguito, una volta preso contatto con gli assoni, prende avvio la formazione della guaina mielinica. Nel corso di questo processo, vengono prodotti più oligodendrociti del necessario e quelli che non prendono contatto con gli assoni muoiono per apoptosi nell’arco di qualche giorno, probabilmente a causa dell’assenza dei segnali di sopravvivenza inviati dagli assoni. La mielina si presenta come una sostanza gelatinosa, ricca di lipidi e, in minor misura, di proteine ed acqua. I lipidi, tra cui colesterolo, cerebrosidi, sulfatidi, fosfolipidi e sfingomieline, costituiscono fino all’80% del peso secco della mielina compatta. A livello ultrastrutturale, la mielina appare costituita da una spirale di multipli avvolgimenti di membrana plasmatica degli oligodendrociti attorno agli assoni. L’avvolgimento spiraliforme delle membrane plasmatiche crea quindi una struttura multilamellare compatta. La guaina mielinica non è continua lungo l’assone, ma è composta di unità discrete di mielina (o segmenti internodali) che si estendono da un nodo di Ranvier al successivo. La conseguenza diretta del danno e della morte degli oligodendrociti è la demielinizzazione dell’assone e il rallentamento o il blocco della conduzione del potenziale d’azione. Oltre a favorire la conduzione dell’impulso nervoso, gli oligodendrociti influenzano molte caratteristiche funzionali dell’assone e del neurone. È stato dimostrato che la presenza della guaina mielinica influenza il diametro dell’assone, la localizzazione dei canali per il sodio ai nodi di Ranvier e il trasporto assonale. Più in generale, gli oligodendrociti, attraverso lo stretto contatto con l’assone, sembrano esercitare effetti trofici e neuroprotettivi. Non tutti i precursori degli oligodendrociti differenziano durante lo sviluppo. Il cervello adulto conserva una significativa popolazione di tali precursori, potenzialmente in grado di migrare, proliferare e riparare le eventuali lesioni alla mielina (remielinizzazione). L’effettiva capacità dei precursori del cervello adulto di riparare la guaina mielinica sembra, tuttavia, condizionata da molti fattori e resta ancora da spiegare perché in alcune condizioni patologiche, come la sclerosi multipla, il processo di remielinizzazione sia inefficace.
Microglia
La microglia si differenzia dalla macroglia per dimensioni e origine, e rappresenta la popolazione di cellule immunocompetenti del sistema nervoso centrale. Dopo un lungo dibattito, la teoria a oggi più accreditata è che la microglia derivi da precursori mieloidi, infiltrati nel sistema nervoso nelle primissime fasi di sviluppo embrionale. È stato ipotizzato che i precursori della microglia migrino nel sistema nervoso in virtù di specifiche proprietà funzionali, che li contraddistinguono dai precursori mieloidi che daranno origine alla linea monocitomacrofagica dei tessuti periferici. La microglia rappresenta circa il 10% delle cellule del sistema nervoso e, sebbene presente in tutto il parenchima cerebrale, ha una densità variabile da regione a regione, raggiungendo le concentrazioni maggiori nell’ippocampo, nei gangli basali e nella sostanza nera. Nel cervello immaturo, le cellule della microglia presentano una morfologia rotondeggiante o ameboide, tipica dei macrofagi periferici attivati, e sono coinvolte nella rimozione per fagocitosi delle cellule che degenerano durante le fasi di sviluppo e formazione del sistema nervoso. Nel primo periodo postnatale, la morfologia della microglia ameboide cambia gradualmente fino ad assumere un aspetto ramificato, caratterizzato da un piccolo corpo cellulare con lunghi processi filamentosi. Questa morfologia è tipica della microglia del cervello normale adulto e corrisponde a un fenotipo funzionale particolarmente quiescente, se confrontato con i macrofagi residenti nei tessuti periferici. Lo stato quiescente, o resting, rappresenta un particolare adattamento della microglia al microambiente del parenchima cerebrale. Tra gli elementi che contribuiscono a mantenere lo stato quiescente sono particolarmente rilevanti le interazioni microgliaastrociti e microglia-neuroni e la presenza della barriera ematoencefalica, che permette l’esclusione dal parenchima cerebrale di sostanze attivanti di origine ematica. L’apparente quiescenza della microglia nel cervello adulto, in condizioni fisiologiche, non deve essere interpretata come uno stato di inattività. Al contrario, studi eseguiti con tecniche avanzate di microscopia in vivo, hanno dimostrato che la microglia ramificata sorveglia attivamente il parenchima circostante attraverso i propri processi citoplasmatici, dinamicamente estesi e retratti come sonde per rivelare le eventuali alterazioni del microambiente. In caso di danno o di eventi patologici di varia natura, la microglia risponde con un rapido ritorno alla morfologia ameboide e l’acquisizione di proprietà tipicamente macrofagiche, necessarie all’innesco di una risposta infiammatoria locale. In questo stato, definito attivato, la microglia può rilasciare una vasta gamma di sostanze, tra cui citochine, mediatori lipidici, radicali liberi, fattori di crescita. La presenza di microglia con morfologia attivata è un tratto comune a quasi tutte le patologie cerebrali. Tuttavia, il suo ruolo nei processi neurodegenerativi non è ancora del tutto chiarito.
Glia e malattie del sistema nervoso
Molte patologie del sistema nervoso sono riconducibili ad alterazioni o difetti nelle funzioni della glia. L’eccessiva risposta microgliale contribuisce in molti casi al meccanismo patogenetico e di neurodegenerazione, in patologie sia di tipo acuto, come l’ischemia cerebrale, sia di tipo cronico, come la malattia di Alzheimer. L’infiammazione e l’attivazione della microglia sono state chiamate in causa anche in patologie neurologiche del neonato e del bambino, come paralisi cerebrale e leucomalacia periventricolare, ma anche epilessia e autismo.
È bene comunque ricordare che l’attivazione microgliale è una reazione di difesa dell’organismo e che il ripristino dell’omeostasi tissutale dipende dal delicato equilibrio tra le funzioni pro-infiammatorie potenzialmente dannose e quelle più propriamente neuroprotettive. Anche gli astrociti contribuiscono alla risposta infiammatoria locale, sia formando un tessuto cicatriziale che delimita la zona di lesione, sia rilasciando sostanze proinfiammatorie e citotossiche che, come per la microglia, possono contribuire al danno neuronale. Un caso esemplificativo è quello della sclerosi laterale amiotrofica (➔), malattia caratterizzata dalla progressiva morte dei motoneuroni. Studi sui modelli animali hanno dimostrato che sia la microglia sia gli astrociti contribuiscono alla degenerazione dei motoneuroni, attraverso diversi meccanismi che coinvolgono il rilascio di radicali liberi e di sostanze neurotossiche. Inoltre, in questa patologia gli astrociti hanno una ridotta espressione del trasportatore per il glutammato EAAT-1 e una diminuita capacità di rimuovere glutammato dallo spazio extracellulare, favorendo l’instaurarsi di fenomeni di eccitotossicità e di morte neuronale. Infine, il danno e la morte degli oligodendrociti, e la conseguente perdita della guaina mielinica, sono eventi tipici di importanti patologie demielinizzanti come la sclerosi multipla, una malattia che colpisce giovani adulti, soprattutto donne, e che porta a gravi disabilità. Tuttavia, la perdita di oligodendrociti mielinizzanti o dei loro precursori immaturi sta emergendo come tratto comune a molte altre patologie, per es. traumi cerebrali o del midollo spinale, malattia di Alzheimer e corea di Huntington. Oligodendrociti distrofici e alterazioni della guaina mielinica sono stati riscontrati anche in malattie psichiatriche come la schizofrenia. Gli oligodendrociti sono inoltre il bersaglio di molte malattie genetiche caratterizzate dalla perdita o dalla mancata formazione di mielina, genericamente indicate come leucodistrofie (➔). Tra queste, la malattia di Alexander, è un esempio di come le interazioni tra astrociti e oligodendrociti siano importanti per il corretto sviluppo e funzionamento del sistema nervoso centrale. La causa di questa rara e grave forma di leucodistrofia è una mutazione genetica a carico della proteina gliale fibrillare acida degli astrociti, e si manifesta clinicamente con una estesa patologia degli oligodendrociti e la mancata formazione della guaina mielinica. Luisa Minghetti
Ruolo della glia nel rilascio di neurotrofine e nutrienti
La sopravvivenza e la funzionalità dei neuroni dipendono dalle interazioni reciproche che si stabiliscono tra glia e neuroni, sia durante lo sviluppo del sistema nervoso sia nel cervello adulto. Le cellule della glia esprimono recettori e trasportatori per vari neurotrasmettitori, una caratteristica che consente di percepire l’attività neuronale e di rispondere a questa attraverso il rilascio di sostanze neuroattive. Allo stesso tempo, attraverso il rilascio di neurotrasmettitori, i neuroni controllano lo stato funzionale della glia e contribuiscono a prevenire una sua inappropriata attivazione. Il dialogo tra neuroni e glia è mediato anche dall’interazione diretta tra molecole esposte sulla loro superficie, rappresenta un modo efficace per orchestrare le attività delle due componenti cellulari e garantire l’integrità funzionale del sistema nervoso. Due importanti aspetti dello scambio tra neuroni e glia sono il rilascio di neurotrofine, da parte della macroglia e microglia, e di nutrienti come glucosio e acido lattico, da parte degli astrociti.
Neurotrofine e fattori di crescita
Le neurotrofine sono strutturalmente correlate e legano due classi di recettori: i Trk, della famiglia dei recettori tirosinchinasi, e i p75, della superfamiglia dei recettori del TNF (Tumor Necrosis Factor o fattore di necrosi tumorale). Attraverso l’interazione e l’attivazione di questi recettori, le neurotrofine regolano la crescita e la sopravvivenza di specifiche popolazioni di neuroni durante lo sviluppo e nel cervello adulto. Le neurotrofine sono inoltre in grado di influenzare importanti funzioni neuronali come eccitabilità e sinaptogenesi. La glia è un’abbondante fonte di neurotrofine sia in condizioni fisiologiche che in seguito a vari tipi di danno neuronale. In partic., NGF e BDNF sono prodotti da tutti tre i principali tipi di glia (astrociti, oligodendrociti e microglia) del sistema nervoso centrale e dalle cellule di Schwann nel sistema nervoso periferico. L’espressione di questi fattori è aumentata in caso di danno neuronale, soprattutto in astrociti e cellule di Schwann, ed è stato suggerito che l’aumento dei livelli di neurotrofine promuove la rigenerazione delle fibre nervose. Anche NT-3 è ampiamente espressa dalle cellule gliali, mentre la sintesi di NT-4 sembra limitata ad astrociti e cellule di Schwann. Nella microglia, l’espressione di NT-3 è regolata dallo stato di attivazione e limitata a sottopopolazioni microgliali in determinate aree cerebrali, per es. la corteccia. Oltre che dagli oligodendrociti maturi, NT-3 è espressa dai loro precursori, sui quali agisce regolandone proliferazione e sopravvivenza, con un meccanismo autocrino. La glia produce anche altre sostanze, o fattori di crescita, in grado di promuovere la sopravvivenza dei neuroni, soprattutto in seguito alla loro attivazione in caso eventi patologici. Tra questi il TGF-B (Transforming Growth Factor B) e il GDNF (Glial cell line-Derived Neurotrophic Factor). L’espressione di questi fattori aumenta durante la fase di degenerazione neuronale in seguito a una lesione, per ritornare a livelli di normalità dopo la rigenerazione dell’assone. Altri fattori importanti sono CNTF (Ciliary NeuroTrophic Factor) e IGF-1 (Insulin-like Growth Factor-1). Queste proteine potrebbero mediare l’azione neuroprotettiva degli oligodendrociti e di altri tipi gliali, nei confronti di neuroni corticali e cerebellari.
Astrociti come fonti di energia per i neuroni
Gli astrociti occupano una posizione strategica nel parenchima cerebrale, essendo in contatto con diversi componenti cellulari quali neuroni, altri elementi gliali e vasi cerebrali. Già Camillo Golgi, a causa della particolare morfologia e dell’articolata organizzazione, ipotizzava che gli astrociti potessero svolgere un ruolo trofico. I neuroni sono i maggiori consumatori di energia, utilizzata soprattutto per la trasmissione del segnale da un neurone all’altro. In partic., è stato dimostrato che oltre l’80% del consumo di energia nel cervello è utilizzato per sostenere la trasmissione eccitatoria glutammatergica. La fonte principale di energia nel cervello adulto è il glucosio, che attraversa le cellule endoteliali dei vasi capillari per mezzo di una proteina specializzata, il trasportatore per il glucosio (GLUT1), presente anche sulle estremità o end feet degli astrociti che circondano i vasi capillari, rendendo più facile l’assorbimento del glucosio. Entrato negli astrociti, il glucosio può essere immagazzinato sotto forma di glicogeno o utilizzato per fornire energia alla cellula (glicolisi). I neuroni, che possono assorbire il glucosio attraverso un altro tipo di trasportatore (GLUT3), non sono in grado di formare depositi di glicogeno. La presenza sulla membrana degli astrociti di numerosi recettori per neurotrasmettitori e la permeabilità di queste cellule allo ione potassio (K+), consentono agli astrociti di rispondere alle richieste energetiche dei neuroni in maniera adeguata all’intensità dell’attività di trasmissione. Gli astrociti possono far fronte al consumo di energia da parte dei neuroni mobilizzando il glucosio dai depositi di glicogeno e convertendo il glucosio in acido lattico, che viene rilasciato nello spazio extracellulare e reso disponibile ai neuroni come importante substrato energetico. L’energia prodotta durante la glicolisi (in forma di ATP) viene utilizzata dagli astrociti per rimuovere dallo spazio extracellulare sia gli ioni K+ sia il neurotrasmettitore glutammato, attività fondamentali per il mantenimento della funzionalità neuronale. Il glutammato viene poi convertito in glutammina, che fornita ai neuroni viene da questi trasformata di nuovo in glutammato. Il processo, definito ciclo del glutammato-glutammina, consente ai neuroni glutammatergici di ricostituire il pool del neurotrasmettitore e garantire il mantenimento della trasmissione eccitatoria.
© Istituto della Enciclopedia Italiana - Riproduzione riservata