Criologia
Enciclopedia on line
Parte della fisica (detta anche criogenia o criogenica) che si occupa dei problemi inerenti alla struttura della materia e al suo comportamento alle bassissime temperature (dallo zero assoluto della scala termodinamica fino a poche decine di gradi al disopra dello zero assoluto), e l’insieme delle tecniche di produzione e utilizzazione di tali temperature. La c. è talvolta distinta, per ciò che concerne gli aspetti più propriamente scientifici, in criofisica e criochimica.
Aspetti generali
Quasi tutte le proprietà della materia subiscono notevoli modificazioni a temperature inferiori ai 20 K. Questi furono raggiunti per la prima volta da J. Dewar nel 1898 con la liquefazione dell’idrogeno, ottenuta usando l’effetto Joule-Thomson (➔ Joule, James Prescott) e uno scambiatore di calore in controcorrente. Con la liquefazione dell’elio, ottenuta per la prima volta da H. Kamerlingh-Onnes nel 1908 usando il metodo di Dewar, è possibile raggiungere la temperatura di 4 K; facendo evaporare rapidamente dell’elio liquido si raggiungono temperature di circa 1 K. Magnetizzando isotermicamente un sale paramagnetico alla temperatura di circa 1 K, il sale cede calore e facendo seguire una smagnetizzazione adiabatica si ottiene un abbassamento della temperatura (effetto magneto-calorico). Con questo metodo, ideato da W.F. Giauque e da P. Debye nel 1926 e realizzato per la prima volta nel 1933 dallo stesso Giauque e da D.P. MacDougall, è possibile raggiungere temperature dell’ordine di 10−3 K. Successivamente, nel 1956 F.E. Simon e N. Kurti hanno eseguito i primi esperimenti di smagnetizzazione adiabatica dei nuclei di un sale paramagnetico, mediante la quale si possono ottenere temperature dell’ordine di 10−6 K. Temperature ancora inferiori sono state raggiunte su piccoli insieme di atomi (contenenti, per es., 1000 atomi) usando in sequenza tecniche di raffreddamento laser ed espansione adiabatica. La temperatura più bassa così raggiunta (dal gruppo di W. Ketterle nel 2005) è di circa 500 × 10−12 K.
I fenomeni più significativi che hanno luogo alle bassissime temperature sono la superfluidità (➔) e la superconduzione (➔). Su insiemi di atomi, portati a temperature inferiori ai 10−6 K è stata ottenuta la condensazione di Bose-Einstein.
Metodi per ottenere basse temperature
La temperatura, parametro macroscopico legato al contenuto di energia di un sistema termodinamico, può essere diminuita solo con una cessione di energia, come richiede il I principio della termodinamica, ΔU=Q−L, in cui ΔU è la variazione di energia interna in una trasformazione. Per avere una diminuzione di temperatura è necessario che ΔU sia negativa e questo si ottiene con una cessione di calore (Q negativo) e/o con un lavoro (L) fatto dal sistema. In effetti, nelle varie fasi che caratterizzano un processo di raffreddamento figurano entrambe queste trasformazioni: cessione di calore e lavoro fatto dal sistema. Nei vari apparati criogenici esiste una parte del dispositivo, che è a temperatura ambiente, dove normalmente viene ceduto il calore, e una parte isolata termicamente, perché è la parte fredda (chiamata generalmente criostato), dove avviene la cessione di lavoro. In quasi tutti gli apparati, la sostanza criogenica, che è il sistema termodinamico a cui si è accennato, è un gas; in molti casi, avviene che parte di questo gas viene liquefatto e usato come sorgente di bassa temperatura: infatti un gas liquefatto, tenuto per es. a pressione atmosferica, è un bagno termostatico alla sua temperatura di ebollizione e a tale pressione. Le temperature di ebollizione dei più comuni gas criogenici a pressione atmosferica sono: elio (3He) 3,19, elio (4He) 4,22, idrogeno 20,5, azoto 77,32, ossigeno 90,2 K.
Metodo Linde-Hampson. - Comprende essenzialmente tre fasi, percorse ciclicamente da un gas. La prima fase è di compressione a temperatura ambiente, in cui il calore di compressione è ceduto, per es., ad acqua. Nella seconda fase avviene un’espansione di Joule-Thomson, senza lavoro esterno, in cui il gas si raffredda e, a regime, una frazione di esso può liquefare; la parte non liquefatta ritorna al compressore, a temperatura ambiente. La terza fase consiste in uno scambio di calore in cui il gas freddo di ritorno abbassa la temperatura del gas compresso in entrata, rendendo così più efficace l’espansione finale. Se lo scopo è quello di produrre gas liquefatto, all’aspirazione del compressore deve essere rifornita con continuità una quantità di gas pari a quella che si liquefa nel criostato. Questo metodo è utilizzabile solo quando la temperatura iniziale dell’espansione è inferiore alla cosiddetta temperatura di inversione del gas; altrimenti, un’espansione senza lavoro esterno può addirittura provocare un riscaldamento del gas. In pratica non si può usare questo metodo, partendo da temperatura ambiente, per il neo, l’idrogeno e l’elio.
Metodo Claude. - Ha uno stadio in più rispetto al metodo Linde-Hampson: un’espansione con lavoro esterno. Il gas compresso, dopo essere passato nello scambiatore di calore, viene diviso in due flussi: una parte subisce un’espansione in un cilindro dove cede parte della propria energia a un pistone mobile, con lavoro esterno. Questo lavoro esterno provoca una diminuzione di temperatura e il gas così raffreddato passa in un secondo scambiatore di calore, nel quale raffredda l’altra frazione di gas compresso, il quale viene poi sottoposto a un’espansione Joule-Thomson, come nel metodo precedente. In tal modo si riesce a raffreddare qualunque gas a temperature più basse della temperatura di inversione e se ne può quindi ottenere la liquefazione.
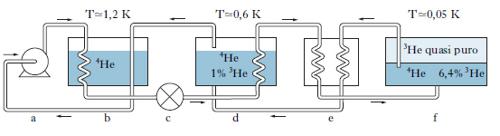
Temperature inferiori a 1 K. - Per ottenere temperature inferiori a 1 K, che è il limite pratico raggiungibile con l’elio naturale, viene utilizzato l’isotopo raro dell’elio 3He. Ricordiamo al riguardo che l’elio naturale è formato quasi interamente dall’isotopo 4He; l’3He è estremamente raro in natura, ma è prodotto artificialmente in quantità apprezzabile dal decadimento radioattivo β del tritio (3H). L’4He e l’3He rimangono liquidi a pressione ordinaria, a temperature comunque basse: infatti non presentano punto triplo e possono essere solidificati soltanto con pressioni di almeno qualche decina di bar. L’3He differisce dall’4He principalmente perché presenta il fenomeno della superfluidità solamente a temperature di pochi millesimi di kelvin, e inoltre perché ha una tensione di vapore notevolmente superiore, a parità di temperatura, a quella dell’altro isotopo. Questa caratteristica è stata sfruttata per ottenere temperature inferiori, in un bagno di 3He, di quelle ottenibili con l’4He. Un refrigeratore a 3He è costituito da una cella contenente una certa quantità di questo isotopo allo stato liquido, schermata termicamente con un criostato a 4He a circa 1-2 K. Riducendo la tensione di vapore dell’3He con una pompa da vuoto si possono raggiungere pressioni di circa un decimo di pascal, che corrispondono a temperature di 0,3 K. Il refrigeratore a smiscelamento 3He-4He (fig. 1), che fu messo a punto nel 1966 in Inghilterra, si basa su un fenomeno scoperto dieci anni prima: lo smiscelamento di una miscela di 3He-4He al di sotto di 0,83 K. Infatti per temperature inferiori a questa, una miscela dei due isotopi si separa in due fasi: una ricca in 3He, l’altra ricca in 4He. Le percentuali di arricchimento sono funzioni della temperatura; le due fasi hanno diversa densità e così in una cella che contenga la miscela in equilibrio, la fase ricca di 3He, che è la più leggera, si trova al di sopra dell’altra. Estraendo, tramite evaporazione, dalla fase ricca di 4He una certa quantità di 3He, si squilibra il sistema, che, per riportarsi nuovamente all’equilibrio, deve far passare dell’3He dalla fase concentrata a quella diluita. Questo passaggio avviene con assorbimento di energia dal sistema.
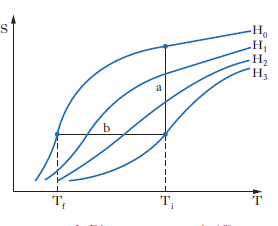
Refrigeratori a smagnetizzazione adiabatica. - Si basano sulla variazione delle proprietà termodinamiche dei materiali paramagnetici in funzione del campo magnetico esterno. La fig. 2, che mostra l’andamento delle curve entropia-temperatura per diversi valori del campo, spiega anche il principio di funzionamento di un refrigeratore magnetico. Si considerino i due segmenti a e b che rappresentano due trasformazioni della sostanza paramagnetica. Il tratto a rappresenta una magnetizzazione isoterma: la sostanza viene portata da campo nullo H0 a campo H3 e contemporaneamente mantenuta a temperatura costante, sottraendogli una quantità di calore chiamata calore di magnetizzazione. Il tratto b è la smagnetizzazione adiabatica che provoca l’abbassamento della temperatura da Ti a Tf. In questo tratto la sostanza è isolata termicamente, dopo di che il campo magnetico viene portato a zero. Se tale processo è compiuto con sufficiente lentezza, esso può essere considerato con buona approssimazione reversibile e quindi a entropia costante: tale è appunto il tratto b. Affinché la diminuzione di temperatura sia apprezzabile, le energie associate ai processi magnetici debbono essere dello stesso ordine dell’energia termica totale del sistema, cioè della sostanza paramagnetica. Si vede che questo avviene quando la temperatura iniziale Ti è dell’ordine di 1 K: allora Tf, la temperatura raggiungibile con questo processo, può essere di circa 10−3 K. È necessario pertanto raffreddare la sostanza paramagnetica (molto usati sono gli allumi di Fe e Cr) alle temperature dell’elio e usare campi magnetici i più intensi possibili: intorno al milione di A/m. Se si vuole raffreddare un campione di un’altra sostanza per studiarne le proprietà a queste temperature estremamente basse, si deve collegare termicamente questo al sale paramagnetico e attendere che esso si raffreddi per contatto.
Termometria alle basse temperature. - Poiché molto spesso la temperatura è mantenuta da un bagno di gas liquefatto e la relazione temperatura-tensione di vapore è ben conosciuta per tutti i gas criogenici, se il sistema è in equilibrio la misurazione della pressione del vapore serve per conoscere la temperatura del bagno. Per l’3He e l’4He, addirittura, la conoscenza della predetta relazione è così accurata che essa definisce attualmente la scala internazionale termometrica tra 5 e 0,3 K. Molto usati sono anche i termometri a termocoppia (fino a circa 1 K) e quelli a resistenza elettrica, in particolare a carbone amorfo o con diodi a semiconduttori (fino a circa 0,1 K). Termometri di questo tipo sono anche molto sensibili: per es., con sensori di carbone amorfo sono state misurate differenze di temperatura di 10−7 K alle temperature di 1-2 K. Temperature più basse (fino a circa 0,004 K) si possono misurare attualmente con i termometri a suscettività magnetica (➔ termometro), che impiegano sali come nitrato di cerio e magnesio, CeMg (NO3)5. Problemi di difficile soluzione in questo campo sono quelli relativi al contatto termico tra termometro e campione di cui si vuol misurare la temperatura e all’esistenza di capacità termiche, che possono essere la causa di sensibili errori.
Recipienti criogenici
La condizione essenziale per poter mantenere in un dato volume una bassa temperatura per il tempo più lungo possibile, è l’isolamento termico. In generale i criostati sono costruiti con pareti doppie o multiple tra le quali è posto un mezzo termicamente isolante. I più antichi sono quelli inventati da Dewar, costruiti in vetro con una doppia parete argentata e con il vuoto nell’intercapedine: il vetro è un buon isolante e riduce molto il flusso termico per conduzione, il vuoto blocca quello per convezione e l’argentatura diminuisce quello per irraggiamento: in simili recipienti (comunemente noti come thermos) di solito le maggiori perdite termiche si hanno dall’apertura di accesso. Oggi si costruiscono anche di metallo, soprattutto di acciaio inossidabile.
I primi recipienti per temperature più basse, per esempio per idrogeno (21 K) o elio (4,2 K) liquidi, si costruivano con un’intercapedine addizionale, riempita con azoto liquido (77 K) come ulteriore schermo termico. Notevoli miglioramenti sono stati ottenuti con l’introduzione, nell’intercapedine a vuoto, di schermi, in parte isolanti e in parte riflettenti, formati da polveri plastiche o da un notevole numero (ca. 100) di sottilissimi fogli di plastica (mylar) metallizzata. Le quantità di gas liquefatti che vengono usate oggi nelle industrie richiedono recipienti sempre più capaci. Sono in uso autobotti per azoto o ossigeno liquido da 20.000 l e recipienti fissi, solitamente di forma sferica, da 2.000.000 di litri e oltre. Si preferisce infatti trasportare i gas allo stato liquido anche quando se ne prevede l’uso gassoso e a temperature ambiente, per motivi puramente economici.
Applicazioni delle basse temperature
L’importanza delle basse temperature è andata crescendo nel 20° sec. ed è tuttora in notevole aumento. Nel campo della propulsione spaziale, molti vettori per veicoli spaziali usano ossigeno liquido come comburente e alcuni stadi usano idrogeno liquido come carburante. In biologia e medicina, le basse temperature hanno interessato vari campi, i più promettenti dei quali sono la conservazione dei tessuti e la criochirurgia. Nel campo delle applicazioni tecniche delle basse temperature, particolare interesse è stato rivolto alla liquefazione di idrocarburi leggeri. Per consentire l’utilizzazione di metano anche in paesi a grande distanza dai luoghi di produzione e non collegabili con metanodotti, si è realizzato un trasporto via mare, mediante metaniere, del gas naturale liquefatto. Negli impianti di liquefazione il gas naturale viene inizialmente compresso, quindi preraffreddato fino a una temperatura prossima a quella di condensazione e infine lasciato espandere rapidamente attraverso una valvola: l’effetto refrigerante provocato da tale espansione isoentalpica (effetto Joule-Thomson) determina la liquefazione. Negli impianti di grande potenzialità il preraffreddamento è in genere realizzato con cicli frigoriferi ausiliari indipendenti, operanti in cascata, cioè con fluidi a temperature di ebollizione progressivamente decrescenti (per es., propano, etilene e metano). Nel campo delle applicazioni tecniche è da ricordare anche il raffreddamento di materiali gommosi a bassa temperatura che in tali condizioni divengono friabili e possono facilmente essere ridotti in polvere più o meno fine. Si hanno già impianti capaci di sottoporre a questo trattamento pneumatici, la cui polvere viene utilizzata come combustibile o per preparare manufatti (pavimentazione per centri sportivi, per campi da tennis ecc.). Come ulteriore applicazione va ricordata la tecnica di conservazione dei cibi mediante congelamento rapido, con azoto liquido. Infine, di estremo interesse sono le possibilità offerte dalle basse temperature, connesse con la superconduzione (➔), come quella di rotaie a levitazione magnetica. Tra le applicazioni nella ricerca di base, nella fisica delle alte energie sono molto usati bersagli di idrogeno, deuterio, elio liquidi per studiare le interazioni di elettroni, protoni ecc. con i nuclei di questi elementi; camere a bolle di idrogeno o elio liquidi sono usate per rivelare e studiare interazioni subnucleari.
© Istituto della Enciclopedia Italiana - Riproduzione riservata