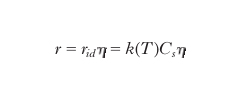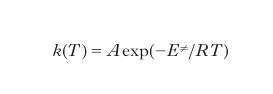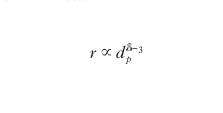CATALISI
Enciclopedia Italiana - VII Appendice (2006)
Catalisi
di Sergio Carrà
Anche se l'impiego della c. risale agli esordi della chimica industriale, essa occupa ancora una posizione di primo piano in diversi aspetti della ricerca scientifica e delle attività applicative, poiché la maggior parte dei prodotti della chimica industriale e farmaceutica vengono ottenuti attraverso reazioni catalitiche. Di grande attualità risultano anche i problemi concernenti il futuro energetico e ambientale del pianeta la cui soluzione richiede l'impiego di rinnovati processi catalitici. Infatti, se grazie allo sviluppo di opportuni catalizzatori basati sull'impiego delle zeoliti ZSM5 (Zeolite Socony Mobil-five) e dei metalli della serie del platino è stato possibile preparare carburanti sempre più efficienti e meno inquinanti, le future frontiere riguardano l'esplorazione di nuove reazioni intese a catturare l'energia solare mediante processi fotocatalitici, per es. attraverso la scissione dell'acqua. La tutela dell'ambiente atmosferico richiede, inoltre, l'individuazione di efficienti catalizzatori in grado di rimuovere o distruggere gli inquinanti che vengono prodotti nei processi di combustione e nelle attività industriali, con l'ambiziosa meta di realizzare dei processi zero waste, nei quali la formazione degli inquinanti risulti trascurabile.
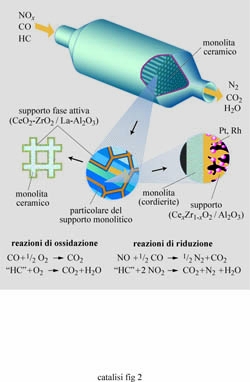
Uno dei successi applicativi della catalisi eterogenea si è avuto nel settore del trasporto attraverso l'introduzione del convertitore o marmitta catalitica, che costituisce il reattore chimico più diffuso poiché rappresenta ormai un corredo indispensabile di ogni autovettura. Frutto di ampie e approfondite ricerche, la marmitta catalitica è un dispositivo che viene applicato per abbattere i componenti inquinanti presenti nei gas di scarico dei motori a combustione interna. Esso ha la configurazione illustrata nella fig. 1, dalla quale risulta che il suo cuore è costituito da una struttura a nido d'ape (honeycomb) dove è presente uno strato di allumina su cui sono depositate le particelle di un catalizzatore complesso che contiene platino, rodio, cerio, zirconio e lantanio. Il platino catalizza l'ossidazione degli idrocarburi e dell'ossido di carbonio, il rodio la riduzione degli ossidi di azoto, mentre il cerio combinato con lo zirconio agisce quale serbatoio di ossigeno per permettere che i menzionati processi di ossidazione abbiano luogo nei momenti in cui i gas di scarico sono ricchi di combustibile. Infine, il lantanio stabilizza l'allumina.
In realtà, i processi catalitici abbondano in natura e si manifestano in diverse situazioni modificando parzialmente la composizione delle diverse correnti fluide esistenti sul pianeta per effetto dell'azione catalitica delle superfici dei minerali. Negli organismi viventi l'intervento degli enzimi, che come è noto costituiscono un'ampia classe di catalizzatori biochimici, condiziona gli eventi che sono alla base dei processi metabolici. La comprensione del loro meccanismo, che sembrava remota sino a qualche decina di anni fa, ha raggiunto attualmente un soddisfacente grado di maturità. In questo quadro anche la soluzione di alcuni problemi di profondo interesse culturale e filosofico come quello dell'origine della vita sulla Terra sembrano essere intimamente connessi con la comprensione degli eventi catalitici che hanno avuto luogo nelle miscele primordiali di composti organici relativamente semplici.
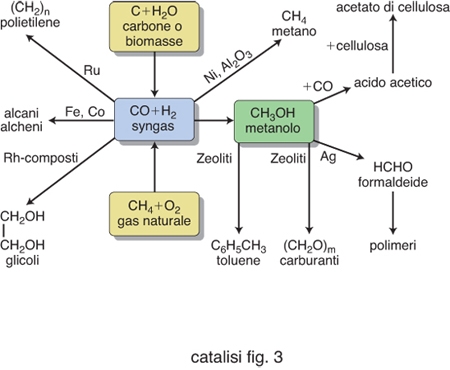
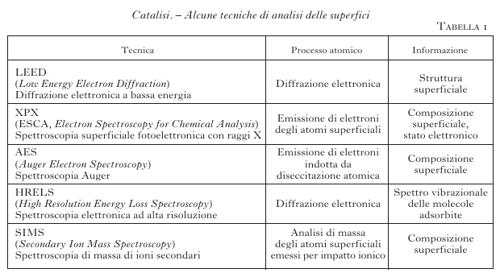
Ma tornando alla chimica industriale è interessante osservare che uno degli aspetti più affascinanti della c. risiede nel fatto che le caratteristiche intrinseche dei catalizzatori solidi possono influenzare in modo radicale la natura dei prodotti ottenuti a partire dagli stessi reagenti. Un esempio significativo ci viene offerto dal comportamento del gas di sintesi costituito da una miscela di ossido di carbonio e idrogeno, che compatibilmente con il catalizzatore impiegato porta a una gamma molto diversificata di prodotti, come viene illustrato nella fig. 2. Si possono infatti ottenere idrocarburi saturi, insaturi e aromatici, alcoli, glicoli, acidi organici e così via. Per questa versatilità la c. costituisce uno strumento di elevata potenzialità per la preparazione di gran parte degli intermedi e dei prodotti richiesti per diverse applicazioni. Partendo da questi presupposti nella seconda metà del secolo scorso sono stati sviluppati interessanti e importanti processi catalitici che costituiscono l'ossatura della chimica industriale moderna. Nella loro attuale impostazione gli studi sulla c. sono volti a un approfondimento del meccanismo delle reazioni in gioco attraverso l'applicazione di metodologie chimico-fisiche in grado di indagare i più sottili dettagli della composizione, della struttura e della configurazione energetica delle superfici solide. Alcune di tali metodologie sono menzionate nella tabella 1. Queste informazioni vengono integrate da calcoli dettagliati e accurati perseguiti mediante i metodi della chimica computazionale che permettono di ottenere adeguate interpretazioni degli eventi che avvengono su scala molecolare.
Un catalizzatore eterogeneo è costituito da particelle solide porose la cui superficie si sviluppa al suo interno attraverso un complesso reticolo di canalicoli. Pertanto perché le molecole dei reagenti vengano catturate, ovvero adsorbite, dalla superficie per dare quindi luogo alle trasformazioni chimiche devono prima diffondersi attraverso i pori stessi. Il processo globale coinvolge quindi più stadi che avvengono in serie, rispettivamente di carattere fisico, quale la diffusione all'interno dei pori del catalizzatore, e chimico che riguardano le reazioni catalitiche vere e proprie. Entrambi questi aspetti intervengono nella progettazione (design) di un buon catalizzatore che risponda alle aspettative. Per approfondire l'analisi del modo in cui i fattori precedenti condizionano la velocità di un processo catalitico è opportuno riferirci alla situazione semplificata di un poro cilindrico di diametro d nel quale entra il reagente che si diffonde attraverso una serie di collisioni con la parete interna del poro sino a essere adsorbito su un punto della superficie stessa dove subisce la trasformazione chimica. La velocità della reazione r, espressa come moli del reagente trasformato a unità di tempo e unità di superficie del catalizzatore, si può scrivere come segue:
In essa compare un termine, che definiremo ideale, proporzionale alla concentrazione Cs del reagente in corrispondenza della superficie, moltiplicato per la costante di velocità di reazione solitamente espressa come segue:
Il fattore A esprime la probabilità intrinseca che la reazione abbia luogo mentre la dipendenza esponenziale dalla temperatura assoluta T dipende dall'energia di attivazione E≠, che rappresenta la barriera di energia che deve essere superata dai reagenti lungo il cammino di reazione perché la reazione abbia luogo; R è la costante universale dei gas. Il parametro adimensionato η, chiamato efficienza del catalizzatore, riflette l'influenza dei processi diffusivi sulla velocità globale in accordo alla seguente definizione:
Nell'espressione all'ultimo membro, ricavata attraverso l'integrazione dell'equazione differenziale che esprime la competizione fra la velocità della reazione chimica e la diffusione all'interno del poro, th indica la tangente iperbolica mentre φ=τ(ζ/Λ)1/2, dove ζ è il rapporto fra superficie e volume del poro, uguale a 4/d se è un cilindro regolare; il parametro Λ=D/k, dato dal rapporto fra il coefficiente di diffusione D del reagente e la costante di velocità k, ha le dimensioni di una lunghezza ed esprime la scala entro cui si svolgono le reazioni chimiche; infine τ è un parametro chiamato tortuosità, uguale a uno per pori regolarmente cilindrici, e minore di uno per i pori la cui irregolarità penalizza la diffusione (i suoi valori sono caratteristici per ciascun catalizzatore e vengono per lo più ottenuti in modo semiempirico attraverso un confronto con i risultati sperimentali).
La trattazione precedente, pur riferendosi a una situazione molto semplificata, evidenzia quali siano i fattori che condizionano il funzionamento di un catalizzatore. In particolare, il valore dell'energia di attivazione gioca un ruolo determinante sulla velocità di reazione, per cui risulta molto importante identificare quali siano le caratteristiche chimiche e strutturali del solido che ne possano diminuire il valore. Viceversa, la determinazione dell'efficienza richiede un esame dettagliato della configurazione geometrica dei pori, delle loro dimensioni, della loro connessione e infine della rugosità della superficie stessa. Questo approccio risulta necessario quando si debba progettare un catalizzatore idoneo all'ottenimento preferenziale di un determinato prodotto attraverso un insieme complesso di trasformazioni in cui sono presenti reazioni contemporanee e successive come si riscontra, per es., nei processi di cracking e ossidazione degli idrocarburi. Poiché i valori specifici dei parametri che sono stati precedentemente menzionati possono influenzare diversamente la velocità delle diverse reazioni in gioco, ne risulta che la selettività del processo globale verso il prodotto desiderato appare profondamente influenzata dalle caratteristiche del catalizzatore stesso.
Entrambi gli aspetti precedenti sono pertanto coinvolti nella modellazione di un catalizzatore seguendo una logica che procede attraverso le seguenti scale: microscopica o atomica (nm), nella quale i processi vengono esplorati sulla base dei modelli molecolari superficiali; mesoscopica (decine di nm), nella quale si studiano sia le caratteristiche dei centri attivi superficiali attraverso l'impiego di tecniche in situ, sia l'influenza della rugosità della superficie sull'interazione fra fenomeni diffusivi e chimici; macroscopica (decine di cm), dove tenendo conto delle caratteristiche geometriche, meccaniche e termiche delle particelle catalitiche si simula mediante le equazioni di conservazione della massa, quantità di moto ed energia, il comportamento dei reattori industriali.
In questo quadro emerge che nello studio dei processi catalitici convergono diverse discipline quali la chimica e la fisica dello stato solido e delle superfici, la cinetica e la dinamica dei sistemi complessi reagenti e, infine, l'ingegneria delle reazioni chimiche.
Chimica bidimensionale
Per lungo tempo gli studi sulla c. sono stati condotti con un approccio essenzialmente empirico, ma da qualche decennio, grazie a metodologie sperimentali sempre più sofisticate e a metodi di calcolo avanzati, si stanno acquisendo profonde conoscenze sui dettagli degli eventi molecolari coinvolti nei processi catalitici. Questo approccio, che sta letteralmente rinnovando l'intero settore, fa uso di metodologie mediante le quali si ottengono informazioni sulla struttura delle superfici, sui valori dell'energia e sulle caratteristiche delle vibrazioni cui sono soggette le molecole adsorbite. Fra di esse un ruolo particolare va attribuito alla STM (Scanning Tunnelling Microscopy) che permette di individuare la posizione degli atomi che si trovano sulla superficie.
La maggioranza dei catalizzatori industriali è costituita da solidi di elevata area superficiale sui quali il componente attivo è disperso sotto la forma di particelle aventi dimensioni comprese fra 1 e 20 nm. Alcuni di tali supporti si possono considerare inerti ma talora esercitano un'azione catalitica che risulta complementare a quella della componente metallica. Un esempio classico è quello dell'allumina che, impiegata per supportare particelle di platino che esercitano sugli idrocarburi un'azione deidrogenante, si comporta a sua volta come catalizzatore per quei processi di isomerizzazione che ristrutturano lo scheletro stesso degli idrocarburi. L'impiego dei menzionati metodi di caratterizzazione permette di approfondire a livello molecolare il rapporto esistente fra le proprietà delle nanoparticelle e le loro caratteristiche catalitiche. Combinando questi risultati con le conoscenze relative ai metodi di sintesi di tali particelle si aprono nuove e stimolanti prospettive sulla progettazione e sullo sviluppo di nuovi catalizzatori.
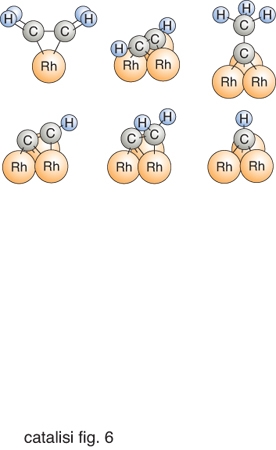
Lo studio dei processi chimici bidimensionali che avvengono su una superficie solida può essere perseguito assimilando le specie adsorbite ai corrispondenti composti organometallici che si preparano per sintesi in soluzioni omogenee, e alcuni di tali esempi sono illustrati nella fig. 3. In questo caso la struttura nota di un composto organometallico può costituire il modello per la specie adsorbita. Questo approccio permette anche di fruire delle informazioni che sono da noi conosciute sui meccanismi delle reazioni catalitiche omogenee per la formulazione dei modelli delle corrispondenti reazioni eterogenee.
Nel quadro precedente gioca un ruolo importante il concetto di centro attivo, vale a dire di quel gruppo di atomi superficiali su cui viene adsorbita la molecola reagente che subisce successivamente la trasformazione catalitica. Sulla stessa superficie possono essere presenti diversi tipi di centri attivi ciascuno dei quali viene coinvolto in reazioni diverse. Il cammino energetico che viene seguito per passare dai reagenti ai prodotti di reazione implica una successione di trasformazioni, o stadi, e un esempio significativo ci viene offerto dalla reazione di sintesi dell'ammoniaca a partire da idrogeno e azoto. Si tratta di una delle reazioni catalitiche più profondamente studiate sia per il suo intrinseco interesse scientifico sia per la sua rilevanza applicativa poiché la realizzazione della fissazione dell'azoto dell'aria per formare ammoniaca, che sta alla base della preparazione di fertilizzanti sintetici, ha costituito un autentico punto di svolta nella storia dell'umanità. Tale cammino di reazione è riportato nella fig. 4, nella quale vengono illustrati i diversi stadi di adsorbimento dei reagenti sui centri attivi e di interazione superficiale delle specie intermedie. Ognuno di tali eventi comporta il superamento di una barriera di energia potenziale la cui altezza si identifica con l'energia di attivazione della reazione.
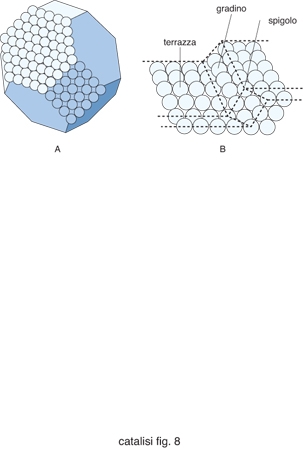
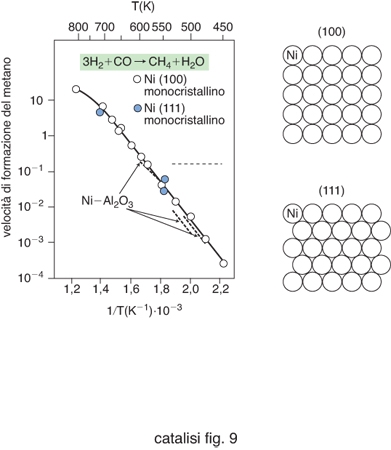
L'analisi dei centri attivi superficiali è intesa a individuare i gruppi di atomi in essi presenti e la loro configurazione geometrica. È possibile così identificare alcune tipologie di configurazioni superficiali che partono da un singolo atomo e divengono sempre più complesse per i casi specifici di una particella avente la configurazione di un cubo ottaedro e di un gradino presente su una superficie monocristallina (fig. 5). In entrambi i casi si identificano atomi che hanno un diverso grado di saturazione rispetto a quelli circostanti e che pertanto possono presentare una diversa reattività. In una impostazione geometrica si ipotizza che tali configurazioni esercitino un'azione preferenziale nei riguardi delle reazioni che coinvolgono dei reagenti che presentano una compatibilità morfologica con i centri attivi stessi. Per verificare questa ipotesi si è studiato come dipende l'attività di un catalizzatore dalla struttura della sua superficie. A titolo di esempio nella fig. 6 vengono riportati i risultati ottenuti nello studio della reazione di riduzione dell'ossido di carbonio con formazione di metano, condotta su un catalizzatore costituito da nichel metallico. Nel diagramma vengono riportati i valori sperimentali della velocità della reazione riferita all'unità della superficie del metallo in funzione dell'inverso della temperatura. I dati si riferiscono a prove condotte su superfici di nichel monocristallino, aventi rispettivamente le due strutture illustrate nella figura stessa e indicate (100) e (111). Inoltre vengono riportati i risultati ottenuti operando su particelle di nichel metallico supportate su allumina. Si può osservare che i valori misurati della velocità di reazione su materiali catalitici aventi le stesse caratteristiche chimiche ma diversa struttura sono del tutto confrontabili. Questo risultato mette in evidenza che la struttura della superficie non influisce sulla velocità della reazione. Si tratta di un comportamento che viene definito insensibile alla struttura (structure insensitive).
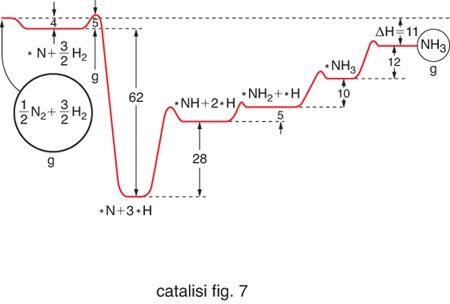
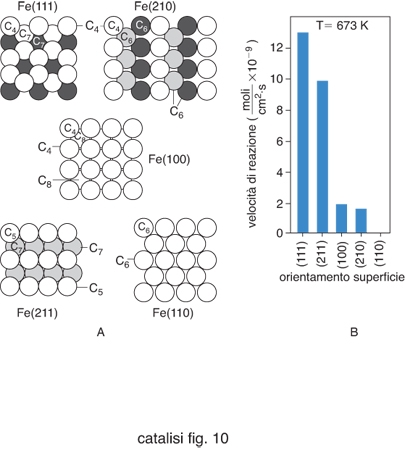
Molte reazioni catalitiche eterogenee si comportano però in modo diverso dal precedente, e un esempio ci viene offerto dalla menzionata reazione di sintesi dell'ammoniaca, che è stata condotta impiegando come catalizzatori diverse superfici monocristalline di ferro e quindi aventi gli atomi superficiali con un diverso grado di coordinazione. Come riportato nella fig. 7 i valori sperimentali della velocità di reazione hanno valori significativamente diversi. Reazioni di questo tipo vengono chiamate sensibili alla struttura (structure sensitive). Talora si riscontrano dei risultati ancora più curiosi, come si verifica con l'oro, sempre ritenuto inerte dal punto di vista catalitico, che depositato a elevata dispersione su un supporto di ossido di titanio presenta una spiccata attività nell'ossidazione del monossido di carbonio ad anidride carbonica. L'analisi con la tecnica STM accoppiata con lo studio dell'attività catalitica ha evidenziato che soltanto le particelle con dimensioni comprese fra 2 e 3 nm risultano attive, confermando una spiccata sensibilità alla struttura del processo catalitico stesso. Per interpretare in termini razionali i comportamenti precedenti è opportuno attribuire alle particelle la configurazione di un cubo ottaedro, illustrato nella fig. 5A, avente dimensione dp. È allora possibile calcolare come variano in funzione della dp stessa i numeri degli atomi che si trovano sugli angoli del cubo ottaedro, quelli che si trovano sugli spigoli e, infine, di quelli che si trovano sulla superficie. Ovviamente tali atomi hanno un diverso grado di coordinazione con gli atomi a essi adiacenti. Assumendo che a ciascuno di essi vada attribuita una diversa attività catalitica si dimostra che la velocità di reazione r risulta:
Il parametro δ viene chiamato dimensione della reazione e in base al precedente modello geometrico dovrebbe assumere i seguenti valori: 0, se la reazione avviene sugli angoli; 1, se la reazione avviene sugli spigoli; infine 2, se la reazione avviene sulle superfici ed è pertanto structure insensitive.
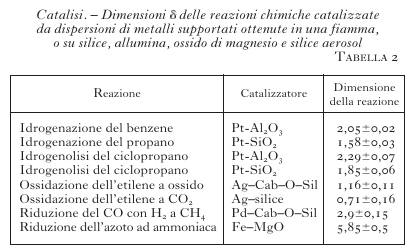
Il valore di δ è stato valutato sperimentalmente per diverse reazioni determinando come varia la loro velocità al variare del diametro delle particelle del catalizzatore. I risultati sono riassunti nella tabella 2 per diversi significativi esempi di processi catalitici. Si può osservare che in alcuni casi tale valore risulta superiore a 2. Questo risultato indica che la popolazione dei centri attivi cresce più rapidamente di quanto previsto dall'aumento dell'area della superficie. Questo risultato è compatibile con l'ipotesi che la superficie abbia una struttura frattale, ovvero tale che il numero di oggetti di estensione L richiesti per ricoprirla venga espresso da L−Df. Df è una dimensione, definita frattale, che assume valori non interi compresi fra 0 e 3, e comunque inferiori alle dimensioni euclidee che nel caso di una superficie sono 2.
È interessante osservare che la reazione di sintesi dell'ammoniaca, che come abbiamo visto è molto sensibile alla struttura della superficie, presenti un valore di δ particolarmente elevato. Infine, si deve osservare che le irregolarità geometriche della superficie esercitano una schermatura sui processi diffusivi, e quindi influiscono sull'efficienza del catalizzatore solido che in generale dipende da diversi parametri fra i quali oltre alla dimensione caratteristica dei pori, la lunghezza della scala chimica Λ e il rapporto fra l'area reale, misurabile per es. mediante la microscopia elettronica, e quella apparente valutata sulla base delle caratteristiche geometriche della superficie stessa.
Analisi dei processi superficiali
Per la comprensione microscopica di un processo catalitico eterogeneo è necessario identificare la composizione e la geometria del catalizzatore e determinare l'energia coinvolta nelle trasformazioni chimiche che avvengono sulla superficie stessa. Mediante la meccanica quantistica, fruendo degli sviluppi raggiunti dai calcolatori elettonici, è possibile determinare le energie delle molecole soggette a una reazione durante la quale si rompono dei legami chimici e se ne formano altri. In questa impostazione si fa largo impiego del metodo del funzionale densità (DFT, Density Functional Theory) che permette di descrivere i dettagli energetici degli eventi molecolari con un'accuratezza sufficiente per consentire caute previsioni sul decorso delle reazioni stesse.
Poiché la c. è un fenomeno essenzialmente cinetico i calcoli precedenti sono volti essenzialmente alla valutazione dell'energia di interazione dei reagenti con gli atomi presenti nei centri attivi superficiali e alla sua variazione derivante dai moti atomici che definiscono i possibili cammini di reazione. Per passare dai prodotti ai reagenti è necessario superare una barriera di energia la cui altezza si identifica con il valore dell'energia di attivazione della reazione stessa. Risulta allora possibile calcolare la costante di velocità di reazione mediante la termodinamica statistica, fruendo delle conoscenze sulle caratteristiche geometriche e vibrazionali dello stato di transizione che si trova alla sommità della barriera di energia potenziale.
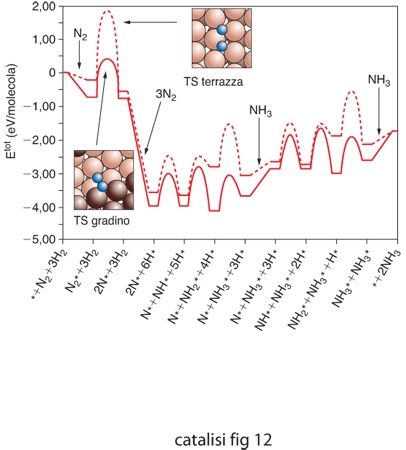
Un interessante esempio riguarda la menzionata reazione di sintesi dell'ammoniaca che, come visto, coinvolge diversi stadi che riguardano l'adsorbimento dell'azoto e dell'idrogeno molecolari e le loro interazioni sulla superficie. Tali calcoli sono stati effettuati su un catalizzatore costituito da una superficie monocristallina di rodio metallico, considerando due casi specifici nei quali la reazione avviene rispettivamente sulla faccia a terrazza del monocristallo o su un gradino come quello illustrato nella fig. 5B. I cammini di reazione così ottenuti sono riportati nella fig. 8. Si può osservare che lo stadio di adsorbimento dissociativo dell'azoto, che costituisce quello limitante la velocità del processo globale, presenta un valore più basso dell'energia di attivazione per la reazione che coinvolge gli atomi di rodio del catalizzatore che fanno parte di siti attivi che si trovano in corrispondenza dei gradini. Non solo, ma l'energia di attivazione risulta molto sensibile all'ambiente locale definito dagli atomi adsorbiti nell'intorno del centro su cui ha luogo la reazione. Pertanto, la velocità globale di reazione dovrà essere valutata mediando opportunamente i valori della velocità sui diversi centri. I valori così ottenuti risultano in ragionevole accordo con i dati sperimentali.
Un altro esempio riguarda la reazione di steam reforming del metano per produrre il gas di sintesi (CH4+H2O→ CO+3H2) condotta su un catalizzatore a base di nichel, la quale si disattiva poiché atomi di carbonio tendono a inserirsi nei cristalli di nichel. Se si opera su un monocristallo nel quale sono inseriti atomi di oro è possibile dimostrare con i calcoli di meccanica quantistica molecolare che la loro presenza ha un duplice effetto. Infatti, anche se comporta la diminuzione in piccola misura della velocità di reazione favorisce nel contempo l'abbattimento della velocità di inserimento degli atomi di carbonio nel reticolo, limitando così il processo di disattivazione. Globalmente l'effetto risulta pertanto positivo.
In conclusione, l'insieme dei fatti precedenti mette in evidenza che gli studi sulla c. si stanno avvicinando a un punto in corrispondenza del quale le ricerche fondamentali sulla struttura delle superfici e sulla cinetica chimica potranno essere applicate con successo non soltanto alla comprensione dei fenomeni in gioco, ma anche alla progettazione di nuovi ed efficaci catalizzatori.
Bibliografia
S. Carrà, M. Morbidelli, Chimica fisica applicata, Milano 1983.
S. Carrà, Aspetti e prospettive della catalisi eterogenea, in La chimica e l'industria, 1993, 75, pp. 88-97.
G.A. Somorjai, Surface chemistry, in The new chemistry, ed. N. Hall, Cambridge 2000, pp. 137-67.