Invecchiamento cerebrale
Dizionario di Medicina (2010)
invecchiamento cerebrale
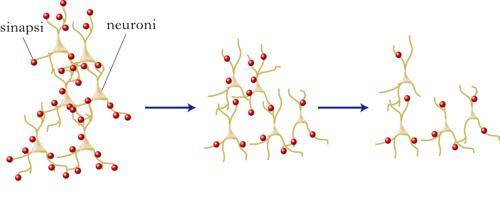
Fisiologiche e graduali modificazioni strutturali e funzionali, cui il cervello va incontro con il passare del tempo. Durante l’i. c. si verifica una riduzione del volume e del numero delle cellule nervose, della morfologia e del numero delle sinapsi. È stato calcolato che a partire dai 30 anni le cellule nervose cominciano a morire per apoptosi (➔). Dopo i 70 anni si possono perdere anche 100.000 neuroni al giorno. La perdita cellulare è notevole in alcune regioni della corteccia cerebrale come il giro temporale superiore (50%) e il polo temporale (10÷25%) e nell’ippocampo (dal 10 al 60%). La regione che più risente degli effetti dell’età è il giro dentato, cruciale per la formazione della memoria e una delle riserve più importanti di precursori neuronali durante la vita adulta. Alcuni nuclei del tronco encefalico e dell’ipotalamo sembrano invece rimanere indenni. La sostanza bianca (soprattutto nella regione prefrontale e nella porzione anteriore del corpo calloso) si riduce di volume e si assottiglia anche la guaina mielinica, una componente della fibra nervosa che svolge un ruolo essenziale nelle funzioni cerebrali, in quanto accelera la velocità di propagazione dell’impulso nervoso. La degenerazione della sostanza bianca potrebbe disconnettere il circuito che collega la corteccia prefrontale, l’ippocampo e lo striato, importante per la memoria e il movimento. Una delle conseguenze di questo depauperamento è la riduzione di circa il 10% della massa dell’encefalo. Tale atrofia cerebrale si traduce, nelle immagini di visualizzazione encefalica, in un aumento delle dimensioni dei ventricoli e degli spazi subaracnoidei.
Perché il cervello invecchia?
Esistono varie ipotesi sulle cause e sulle modalità dell’invecchiamento cerebrale. L’associazione tra mutazioni ereditarie dei geni coinvolti nella riparazione del DNA e sindromi progeroidi segmentali (malattie caratterizzate da rapido e prematuro invecchiamento di tutti gli organi e, nel caso della sindrome di Cockayne, anche da neurodegenerazione precoce) ha fatto ipotizzare che l’invecchiamento sia legato all’accumulo nel tempo di alterazioni non adeguatamente riparate delle macromolecole depositarie dell’informazione genetica. Un’altra ipotesi prevede un programma geneticamente determinato per la senescenza. Questa teoria, basata sull’osservazione che ogni specie animale ha una durata massima della vita, che è fissa, contempla l’esistenza di un orologio – responsabile dell’integrazione delle funzioni endocrina, nervosa e immunitaria – che determina tale durata. Entrambe le ipotesi predicono che la cellula non sia più in grado di tradurre correttamente l’informazione genetica; ciò provocherebbe la soppressione dei geni coinvolti nel traffico intracellulare, nella funzione sinaptica e in quella mitocondriale. Il progressivo malfunzionamento dei mitocondri condurrebbe a una ridotta produzione di ATP (quindi di energia) e a un aumento della produzione di radicali dell’ossigeno. L’incremento degli ossidanti, in associazione con la riduzione dei sistemi antiossidanti di difesa, causerebbe danni estesi ai lipidi, alle proteine e al DNA. A causa della compromissione dell’autofagia e del proteosoma, gli organelli e le molecole danneggiate si accumulerebbero all’interno dei neuroni provocando loro sofferenza e morte.
Alterazioni istologiche e della neurotrasmissione
Molti neuroni accumulano depositi, sopratutto in sede mitocondriale, di lipofuscina, un pigmento granulare scuro composto di residui dell’ossidazione di lipidi e proteine e di alcuni metalli come rame, ferro e manganese. Le cellule postmitotiche come i neuroni sono particolarmente predisposte ad accumulare queste sostanze non digeribili perché, contrariamente alle cellule in divisione, non possono diluire tale materiale nelle cellule figlie. Con la sofferenza progressiva dei neuroni si verificano inevitabilmente anche alterazioni a carico dei neurotrasmettitori e dei loro recettori. Per es., si riducono sia i livelli dell’acetilcolintrasferasi e del GABA, sia il numero dei recettori dell’acetilcolina, della serotonina e delle catecolammine. Altro evento correlato all’età è l’aumento dei livelli della monoamminoossidasi (l’enzima, in sigla MAO, che interviene nella trasformazione e inattivazione delle catecolammine e della serotonina). I suoi effetti deleteri sarebbero da ricondurre alla riduzione dei neurotrasmettori e all’accumulo del perossido di idrogeno (un prodotto della loro attività) che attacca i lipidi di membrana arrecando danni alle cellule.
Conseguenze cliniche
Le conseguenze cliniche delle modificazioni sono difficilmente valutabili. Le qualità intellettuali possono restare inalterate: alcuni personaggi storici sono stati in grado di esprimersi ai più alti livelli nella tarda età. Tuttavia, molti anziani presentano una riduzione nella rapidità e abilità durante l’esecuzione dei movimenti, soprattutto fini e complessi. Dal punto di vista cognitivo l’i. c. comporta un rallentamento nei processi di apprendimento e una riduzione nella velocità di elaborare le informazioni. Indagini di imaging funzionale cerebrale mostrano come queste modificazioni siano riconducibili a un’alterata attivazione della corteccia prefrontale e dell’ippocampo. Queste alterazioni morfologiche non comportano inevitabilmente limitazioni funzionali, perché il cervello dell’anziano può utilizzare anche parti dell’emisfero non dominante. Tuttavia, questo meccanismo compensatorio non è presente nei pazienti con morbo di Alzheimer.
Ambiente e invecchiamento
Il naturale processo di invecchiamento dell’organismo si associa a un declino delle funzioni cognitive che può, almeno in parte, essere imputato a cambiamenti della plasticità neurale cerebrale. Benché siano state caratterizzate numerose disfunzioni neurologiche associate all’invecchiamento fisiologico dell’organismo, esse tendono a essere molto meno gravi delle alterazioni che si osservano in presenza di patologie quali la malattia di Alzheimer o di Parkinson.
Cambiamenti morfologici e funzionali nel cervello anziano
Mentre prima degli anni Ottanta del 20° sec. era opinione diffusa che il cervello di roditore anziano subisse massicce perdite di neuroni rispetto agli stadi giovanili (una diminuzione di densità neuronale stimata tra il 10 e il 60%), l’introduzione di accurati metodi stereologici per la conta delle cellule ha in seguito consentito di dimostrare che la diminuzione del numero di neuroni non è un processo generalizzato. Piuttosto, alcune aree circoscritte, come l’area 8A della corteccia prefrontale dorsolaterale, vanno incontro a una riduzione nel numero di neuroni correlata ad alterazioni comportamentali per compiti che coinvolgono la memoria di lavoro. Analogamente, l’arborizzazione dendritica rimane per lo più invariata in molte aree cerebrali (come l’ippocampo), ma subisce riduzioni anche marcate nella corteccia prefrontale e nella corteccia del cingolo. Anche le spine dendritiche presentano alterazioni locali, poco pronunciate o assenti nel giro dentato e nell’area CA1 (Cornu Ammonis 1) dell’ippocampo ma piuttosto marcate nel subicolo. Queste evidenze trovano conferma nell’uomo. Nei soggetti anziani si evidenzia, mediante risonanza magnetica funzionale o tomografia a emissione di positroni, una ridotta attivazione della corteccia prefrontale in compiti che coinvolgono le funzioni esecutive. A livello cellulare, l’omeostasi del calcio risulta alterata a causa dell’incremento di densità dei canali per il Ca2+ di tipo L, con conseguente aumento della conduttanza per il Ca2+, direttamente coinvolta nei deficit di plasticità che si verificano durante l’invecchiamento. Inoltre, l’invecchiamento comporta la perdita ippocampale di sinapsi, in prevalenza assospinose, e la conseguente riduzione dell’ampiezza dei potenziali di campo postsinaptici eccitatori. Una ridotta densità sinaptica è stata documentata anche nella corteccia frontale di soggetti umani anziani e nelle scimmie. Nel cervello di ratti anziani, risulta deficitaria anche l’espressione di c-fos, un gene appartenente alla classe dei geni immediati-precoci coinvolti nella plasticità neurale. Le alterazioni cellulari indotte dall’invecchiamento cerebrale sono causa dei deficit funzionali a carico dei processi di plasticità sinaptica, quali il potenziamento e la depressione a lungo termine (➔). A livello comportamentale, l’invecchiamento si accompagna a una riduzione delle abilità mnemoniche che colpisce in prevalenza la memoria di lavoro, la memoria verbale e la memoria spaziale; le memorie a lungo termine e la memoria implicita, invece, sono solitamente risparmiate.
Arricchimento ambientale e invecchiamento cerebrale
Nei modelli animali, l’esposizione a un ambiente ricco di stimoli cognitivi, motori e sociali ritarda i processi di invecchiamento cerebrale. L’allevamento di roditori da laboratorio in condizioni di arricchimento ambientale (➔ ambiente e cervello) stimola la plasticità del cervello anche nell’animale anziano, prevenendo o rallentando i processi di morte neuronale e stimolando la neurogenesi nel giro dentato dell’ippocampo. Topi anziani mantenuti in condizioni di arricchimento ambientale dai 10 ai 20 mesi di età mostrano un incremento di cinque volte dei livelli di neurogenesi ippocampale rispetto a topi di controllo mantenuti in condizioni ambientali standard. I livelli di lipofuscina, una sostanza derivante dal metabolismo lipidico indicativa dello stress ossidativo e che si accumula nei neuroni col progredire dell’età, sono ridotti in topi anziani che vivono in un ambiente arricchito. A livello comportamentale, l’arricchimento ambientale previene i deficit di apprendimento e memoria in numerosi compiti che richiedono una corretta funzionalità dell’ippocampo e della corteccia prefrontale. Nell’uomo, fattori legati allo stile di vita, quali il coinvolgimento in attività intellettuali elaborate, le interazioni sociali e l’attività fisica, potenziano la riserva cognitiva dell’individuo, stimolando il mantenimento delle funzioni mentali in vecchiaia e riducendo il rischio di sviluppare malattie neurodegenerative connesse con l’invecchiamento, come la malattia di Alzheimer. Studi epidemiologici mostrano che in donne anziane, portatrici dell’allele ApoE-4 (che costituisce un fattore genetico di rischio per l’Alzheimer familiare), il mantenimento delle prestazioni in compiti uditivi, visivi e spaziali è correlato con i livelli di allenamento aerobico. Nell’invecchiamento non patologico, il miglioramento delle prestazioni cognitive indotto dall’esercizio fisico è particolarmente marcato in compiti che richiedono controllo esecutivo (pianificazione, memoria di lavoro, esecuzione di esercizi a compito multiplo), dipendenti dalla corteccia prefrontale. Un altro fattore ambientale di notevole impatto sui processi di invecchiamento cerebrale è rappresentato dalla dieta. Studi epidemiologici suggeriscono che l’acquisizione giornaliera di vitamina E, flavonoli e acidi omega-3 riduce il rischio di sviluppare la malattia di Alzheimer, effetto questo esaltato dalla combinazione con l’esercizio fisico volontario. Anche la restrizione calorica contrasta gli effetti dell’invecchiamento, incrementando la durata di vita media e la resistenza contro un largo spettro di patologie legate all’invecchiamento stesso.
© Istituto della Enciclopedia Italiana - Riproduzione riservata